题目内容
15.1个SO32-离子恰好将1个XO4-离子还原,则X元素在还原产物中化合价是( )| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 该反应中S元素化合价由+4价变为+6价,XO4-中X化合价为+7价,根据氧化还原反应中得失电子数相等计算X在还原产物中化合价.
解答 解:该反应中S元素化合价由+4价变为+6价,1个SO32-离子恰好将1个XO4-离子还原,则转移电子数为2,XO4-中X化合价为+7价,则发生氧化还原反应时每个X原子得到2个电子,所以X元素在还原产物中化合价为+5价,故选D.
点评 本题考查化学方程式有关计算,为高频考点,明确氧化还原反应中转移电子相等是解本题关键,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
2.对于下列事实的解释错误的是( )
| A. | 浓硫酸使胆矾晶体的蓝色褪去,说明浓硫酸具有吸水性 | |
| B. | 豆科植物根部的根瘤菌可以将空气中的氮由游离态转为化合态是氮的固定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 氨水可使酚酞试剂变为红色,说明氨水显碱性 |
4.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化钠与盐酸;氢氧化铜与盐酸 | B. | BaCl2与Na2SO4;Ba(OH)2与H2SO4 | ||
| C. | Na2CO3与硝酸;CaCO3与硝酸 | D. | 石灰石与硝酸反应;石灰石与盐酸 |
5.在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示.已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B).则此反应可表示为( )
| A. | 2A+3B=2C | B. | A+3B2=C | C. | 3A+B=2C | D. | A+B=C |
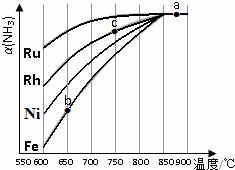 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛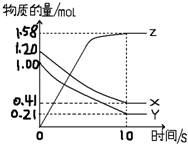 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
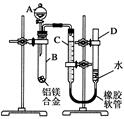 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.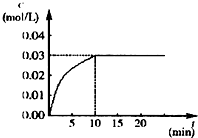 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图: