题目内容
17.对水的电离平衡不产生影响的粒子是( )| A. | HCl | B. | Fe3+ | C. | Al3+ | D. | Cl- |
分析 水的电离平衡方程式为:H2O?H++OH-,根据影响化学平衡的因素分析,加入的物质能够影响水电离的氢离子或者氢氧根离子,就能够对水的电离产生影响,据此进行解答.
解答 解:A、氯化氢能够电离出氢离子,使溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故A错误;
B、铁离子能够结合水电离的氢氧根离子,水的电离平衡向着正向移动,铁离子促进了水的电离,故B错误;
C、铝离子能够结合水电离的氢氧根离子,水的电离平衡向着正向移动,铝离子促进了水的电离,故C错误;
D、氯离子不影响水电离的氢离子或者氢氧根离子,对水的电离没有影响,故D正确;
故选D.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意明确水为弱电解质,加入酸或者碱溶液能够抑制水的电离、加入能够水解的弱酸根离子或者弱碱根离子能够促进水的电离.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
8.常温下,不能证明HA是弱酸的是( )
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
5.在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示.已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B).则此反应可表示为( )
| A. | 2A+3B=2C | B. | A+3B2=C | C. | 3A+B=2C | D. | A+B=C |
2.常温下某溶液中,由水电离出的c(H+)为1×10-12mol/L,该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、SO42-、NO3- | B. | Na+、K+、ClO-、CO32- | ||
| C. | Fe2+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO32- |
9.下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关的是( )
①AlCl3+NaOH ②Na2SiO3+CO2+H2O ③Na+O2
④Fe+Cl2 ⑤Ca(HCO3)2+Ca(OH)2.
①AlCl3+NaOH ②Na2SiO3+CO2+H2O ③Na+O2
④Fe+Cl2 ⑤Ca(HCO3)2+Ca(OH)2.
| A. | ①②⑤ | B. | ②③ | C. | ①⑤ | D. | ④⑤ |
6.关于水的离子积常数,下列说法中不正确的是( )
| A. | 纯水中c(H+)•c(OH-)=1×10-14 | B. | 25℃纯水中c(H+)•c(OH-)=1×10-14 | ||
| C. | 25℃稀盐酸中c(H+)•c(OH-)=1×10-14 | D. | KW值随温度升高而增大 |
7.下列叙述中正确的是(NA为阿伏加德罗常数)( )
| A. | 1mol Na与足量水反应,转移电子数为NA | |
| B. | 同温同压下,相同体积的物质,其物质的量必相等 | |
| C. | 5.3g Na2CO3固体含有的离子数为1.5NA | |
| D. | 标准状况下,22.4L H2O所含的原子数为3 NA |
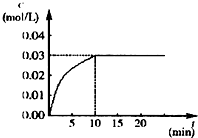 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图: