题目内容
20.短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物.请回答:(1)X、Y、Z元素的名称分别是碳、氮、氢.
(2)X的单质的电子式
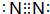 ,Z的原子结构示意图
,Z的原子结构示意图 .
.(3)X、Y的最高价氧化物水化物的酸性强弱(填化学式)HNO3>H2CO3,氢化物的稳定性(填化学式)NH3>CH4.
分析 短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,只能是Z处于第一周期,X、Y处于第二周期,故Z为H元素;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,最外层电子数为4,则Y为C元素;X元素原子最外电子层上的电子数是Y和Z两种元素最外电子层上的电子数的总和,故X原子最外层电子数之和为4+1=5,则X为N元素,N元素和H元素可以形成NH3.
解答 解:短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,只能是Z处于第一周期,X、Y处于第二周期,故Z为H元素;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,最外层电子数为4,则Y为C元素;X元素原子最外电子层上的电子数是Y和Z两种元素最外电子层上的电子数的总和,故X原子最外层电子数之和为4+1=5,则X为N元素,N元素和H元素可以形成NH3.
(1)X、Y、Z元素的名称分别是氮、碳、氢,
故答案为:碳、氮、氢;
(2)X的单质为N2,电子式为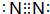 ,Z为H元素,原子结构示意图为
,Z为H元素,原子结构示意图为 ,
,
故答案为: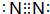 ;
; ;
;
(3)非金属性N>C,故最高价氧化物水化物的酸性:HNO3>H2CO3,氢化物的稳定性:NH3>CH4,
故答案为:HNO3,H2CO3;NH3,CH4.
点评 本题考查结构性质位置关系应用,关键是推断元素,侧重对化学用语与元素周期律的考查,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列电子式书写正确的是( )
| A. | 氯化钠  | B. | 氨气  | C. | NH4Cl的电子式 | D. | 硫化钠 |
11.利用下列反应不能制得括号中纯净物质的是( )
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 等物质的量的氯气与乙烷在光照条件下反应(一氯乙烷) | |
| D. | 液溴与苯用溴化铁作催化剂反应(溴苯) |
5.明•于谦诗:“凿开混沌得乌金,藏蓄阳和意最深.爝火燃回春浩浩,洪炉照破夜沉沉.”这里“乌金”指的是( )
| A. | 煤 | B. | 磁铁矿 | C. | 石油 | D. | 金 |
9.C60分子结构与足球形状相似,它与金刚石互为( )
| A. | 同位素 | B. | 同分异构体 | C. | 同素异形体 | D. | 同种物质 |
10.镁片和锌片用导线连接后插入稀硫酸中,锌片是( )
| A. | 比镁片活泼 | B. | 电子流出极 | C. | 正极 | D. | 负极 |
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题: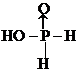 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸.