题目内容
10.下列电子式书写正确的是( )| A. | 氯化钠  | B. | 氨气  | C. | NH4Cl的电子式 | D. | 硫化钠 |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子;
C.氯化铵为离子化合物,氯离子需要标出最外层电子及所带电荷;
D.硫化钠为离子化合物,由2个钠离子和1个硫离子构成.
解答 解:A.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故A错误;
,故A错误;
B.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,故B错误;
,故B错误;
C.NH4Cl为离子化合物,N原子最外层5个电子,Cl原子最外层7个电子,则其电子式为 ,故C错误;
,故C错误;
D.硫化钠为离子化合物,由2个钠离子和1个硫离子构成,两个钠离子和1个硫离子间均以离子键相结合,故电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见电子式的书写,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
14.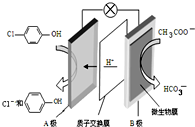 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )
 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A为电池的正极,发生还原反应 | |
| C. | A极的电极反应式为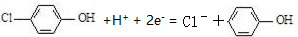 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
1.短周期元素x和y可以相互形成化合物x2y,那么x和y所在族的族数之差可能是( )
| A. | 6 | B. | 3 | C. | 4 | D. | 5 |
18.如图是一些常见有机物的转化关系,下列说法正确的是( )
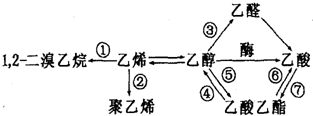

| A. | 反应①需要的条件是光照 | B. | 反应②的反应类型是加聚反应 | ||
| C. | 反应⑤⑦需要稀硫酸做催化剂 | D. | 反应③④⑤⑥⑦都属于取代反应 |
5.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
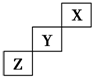

| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质不易发生化学反应 |
15.下列结论错误的个数是( )
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
①微粒半径:r(K+)>r(S2-)
②氢化物的稳定性:HCl>H2S
③还原性:Cl->I-
④氧化性:Cl2>S
⑤酸性:H2SO4>H3PO4
⑥非金属性:O>N
⑦金属性:Mg<Ca.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
2.以下指定溶液中有关离子的物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)>c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液的物质的量浓度:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa两溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHA溶液,测得pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
19.下列反应的生成物为纯净物的是( )
| A. | CH4和Cl2光照 | B. | 甲苯与液溴发生取代反应 | ||
| C. | CH2=CH-CH3与HCl加成产物 | D. | 乙烯和氯化氢加成 |
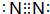 ,Z的原子结构示意图
,Z的原子结构示意图 .
.