题目内容
8. 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:(1)写出制备水合肼反应的离子方程式:2OH-+ClO-+CO(NH2)2=N2H4•H2O+Cl-+CO32-.
(2)向三颈瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是排尽装置中的空气.制备水合肼时,分液漏斗中盛装的药品是含NaOH的NaClO溶液.
(3)水合肼可用于贵重金属的清洗、精炼、回收,用水合胼从氯化银中回收金属银时,生成一种一卤代氮化物(N2H5Cl)和一种无霉的气体单质.写出该反应的化学方程式:4AgCl+5N2H4•H2O═4N2H5Cl+4Ag+N2 ↑+5H2O.
(4)由水合肼脱水可得火箭燃料肼,此时可选用的脱水剂为C(填字母).
A.五氧化二磷 B.浓硫酸 C.氧化钙
(5)有同学认为该实验收集装置有缺陷,请你写出改进措施:在锥 形瓶后加一个装有碱石灰的干燥管,吸收尾气.
(6)实验室用碘量法测定水合肼的浓度:
滴定原理为N2H4•H2O+H2SO4+6NaHCO3+2I2═N2↑+6CO2↑+Na2SO4+4NaI+7H2O.
测定过程:准确量取5.00mL水合肼溶液并将其稀释成100mL溶液,量取20.00mL该溶液于锥形瓶中,并加入适量硫酸、NaHCO3固体,然后再用0.100 0mol•L-1'标准I2溶液滴定终点,消耗标准溶液25.00mL.
①用酸式滴定管量取标准溶液(填“酸式”或“碱式”);若用蒸馏水洗涤滴定管之后,直接注入标准溶液排气泡、调液面、读数等,测得结果会偏高(填“偏高”“偏低”或“无影响”).
②根据上述实验数据.算出原水合肼溶液的物质的量浓度为1.25mol/L.
分析 (1)水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得,根据元素守恒和电荷守恒书写离子方程式;
(2)水合肼(N2H4•H2O)在空气中可吸收CO2,产生烟雾,所以在制备水合肼时要排尽装置中的空气,水合肼是一种强还原剂,所以在制备水合肼时要将含NaOH的NaClO溶液向尿索[CO(NH2)2]溶液中滴加;
(3)用水合胼从氯化银中回收金属银时,生成一种一卤代氮化物(N2H5Cl)和一种无毒的气体单质应为氢气,根据元素守恒可写出该反应的化学方程式;
(4)水合肼具有强碱性,且水合肼是一种强还原剂,据此选择脱水剂;
(5)该实验收集装置缺陷是少一个尾气吸收装置,可以在锥 形瓶后加一个装有碱石灰的干燥管,吸收尾气;
(6)①标准I2溶液有氧化性,所以要装在酸式滴定管中,用蒸馏水洗涤滴定管之后,未用标准液润洗,会使标准液被稀释,据此判断对实验结果的影响;
②根据题意与5.00mL水合肼溶液反应的I2的物质的量为$\frac{100}{20}$×0.100 0mol•L-1×0.025L=0.0125mol,根据方程式N2H4•H2O+H2SO4+6NaHCO3+2I2═N2↑+6CO2↑+Na2SO4+4NaI+7H2O可计算出水合肼的物质的量,进而确定其浓度;
解答 解;(1)水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得,反应的离子方程式为2OH-+ClO-+CO(NH2)2=N2H4•H2O+Cl-+CO32-,
故答案为:2OH-+ClO-+CO(NH2)2=N2H4•H2O+Cl-+CO32-;
(2)水合肼(N2H4•H2O)在空气中可吸收CO2,产生烟雾,所以向三颈瓶中加入溶液之前,应先从右侧导管中通入氮气,以排尽装置中的空气,水合肼是一种强还原剂,所以在制备水合肼时要将含NaOH的NaClO溶液向尿索[CO(NH2)2]溶液中滴加,所以分液漏斗中盛装的药品是含NaOH的NaClO溶液,
故答案为:排尽装置中的空气;含NaOH的NaClO溶液;
(3)用水合胼从氯化银中回收金属银时,生成一种一卤代氮化物(N2H5Cl)和一种无毒的气体单质应为氢气,根据元素守恒可知该反应的化学方程式为4AgCl+5N2H4•H2O═4N2H5Cl+4Ag+N2 ↑+5H2O,
故答案为:4AgCl+5N2H4•H2O═4N2H5Cl+4Ag+N2 ↑+5H2O;
(4)水合肼具有强碱性,且水合肼是一种强还原剂,脱水剂可用氧化钙,故选C;
(5)该实验收集装置缺陷是少一个尾气吸收装置,可以在锥 形瓶后加一个装有碱石灰的干燥管,吸收尾气,
故答案为:在锥 形瓶后加一个装有碱石灰的干燥管,吸收尾气;
(6)①标准I2溶液有氧化性,所以要装在酸式滴定管中,用蒸馏水洗涤滴定管之后,未用标准液润洗,会使标准液被稀释,会使测得结果偏高,
故答案为:酸式;偏高;
②根据题意与5.00mL水合肼溶液反应的I2的物质的量为$\frac{100}{20}$×0.100 0mol•L-1×0.025L=0.0125mol,根据方程式N2H4•H2O+H2SO4+6NaHCO3+2I2═N2↑+6CO2↑+Na2SO4+4NaI+7H2O可计算出水合肼的物质的量为$\frac{1}{2}×$0.0125mol=0.00625mol,所以原水合肼溶液的物质的量浓度为$\frac{0.00625mol}{0.005L}$=1.25mol/L,
故答案为:1.25mol/L.
点评 本题考查水合肼的制备,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.

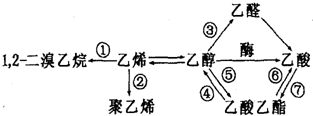
| A. | 反应①需要的条件是光照 | B. | 反应②的反应类型是加聚反应 | ||
| C. | 反应⑤⑦需要稀硫酸做催化剂 | D. | 反应③④⑤⑥⑦都属于取代反应 |
| A. | CH4和Cl2光照 | B. | 甲苯与液溴发生取代反应 | ||
| C. | CH2=CH-CH3与HCl加成产物 | D. | 乙烯和氯化氢加成 |

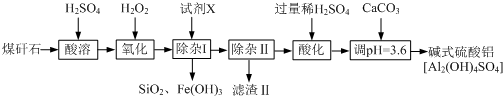
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co(OH)3发生反应的离子方程式2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,则a的范围是5.2≤PH<7.6.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解;
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0〜2.5 B.3.0〜3.5 C.4.0〜4.5 D.5.0〜5.5
(6)操作1为蒸发浓缩、冷却结晶、过滤.
(7)实验室用足量的浓盐酸完全溶解一定量的钴的氧化物Cox0y(其中钴的化合价为+2、+3),若得到含13gCoCl2的溶液并产生标准状况下448mL的黄绿色气体,则y:x=6:5.
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题: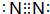 ,Z的原子结构示意图
,Z的原子结构示意图 .
.