题目内容
20.硼及其化合物具有重要的工业用途,某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收镁和其中另一种金属单质的工艺流程如图1:(1)滤液I所含金属离子的主要成分为Na+、AlO2-;可回收的金属A的原子结构示意图为
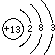 .
.(2)试剂B为盐酸,“浸出”步骤中,为提高镁的浸出率,可采取的措施有研磨固体废料;增大盐酸浓度;加热升高温度、边加盐酸边搅研拌(要求写出两条措施)
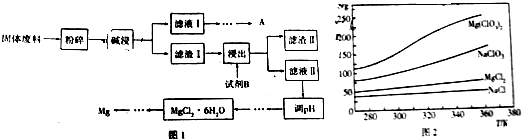
(3)Mg(ClO3)2在农业上有广泛的用途,可用NaClO3与 MgCl2制备,已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
①该反应的化学方程式为2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,该反应能进行的原因是在相同温度下,由于NaCl溶解度较小最先析出,Mg(ClO3)2剩余在溶液中通过蒸发结晶可得.
②从溶液中制备Mg(ClO3)2晶体的操作方法为蒸发浓缩、冷却结晶.
分析 固体废料中含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3,经碱浸后分离,得到滤液Ⅰ主要含有NaAlO2,可回收金属Al,滤渣Ⅰ含有MgCO3、MgSiO3、CaMg(CO3)2、Fe2O3等,加入盐酸浸泡,得到滤渣Ⅱ含有硅酸,滤液Ⅱ含有氯化镁、氯化钙以及氯化铁等,调节溶液pH,可除去氯化铁、氯化钙等,得到氯化镁晶体,最终电解熔融的氯化镁可得到镁,以此解答该题.
解答 解:固体废料中含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3,经碱浸后分离,得到滤液Ⅰ主要含有NaAlO2,可回收金属Al,滤渣Ⅰ含有MgCO3、MgSiO3、CaMg(CO3)2、Fe2O3等,加入盐酸浸泡,得到滤渣Ⅱ含有硅酸,滤液Ⅱ含有氯化镁、氯化钙以及氯化铁等,调节溶液pH,可除去氯化铁、氯化钙等,得到氯化镁晶体,最终电解熔融的氯化镁可得到镁,
(1)氧化铝能溶于氢氧化钠,生成偏铝酸钠和水,含有的金属离子的主要成分为Na+、AlO2-,碱浸后的滤液中含有的金属是Al,Al有3个电子层,最外层电子数为3,Al的原子结构示意图为: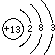 ,
,
故答案为:Na+、AlO2-;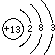 ;
;
(2)由以上分析可知试剂B为盐酸,从化学反应速率和化学平衡的影响因素来看,可以通过增大接触面积提高反应速率,提高镁的浸出率,可通过升高温度提高氯化镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,
故答案为:盐酸;研磨固体废料;增大盐酸浓度;加热升高温度、边加盐酸边搅研拌;
(3)①依据题意得出反应物为:NaClO3和MgCl2,生成物为:Mg(ClO3)2,故化学反应方程式为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,在相同温度下,由于NaCl溶解度较小最先析出,在降温的过程中,Mg(ClO3)2的溶解度也不断减小,从溶液中析出,通过蒸发结晶即可获取,
故答案为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;在相同温度下,由于NaCl溶解度较小最先析出,Mg(ClO3)2剩余在溶液中通过蒸发结晶可得;
②从溶液中得到晶体,可进行蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识,为高考常见题型,同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度较大.

| A. | FeCl2 | B. | Fe(OH)3 | C. | FeS | D. | CuS |
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
(2)B、C、D三种元素按原子半径由大到小的顺序排列为Na>Mg>Al(用元素符号表示)
(3)F元素简单氢化物的化学式是H2O,H元素跟B元素形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(4)G元素和H元素两者核电荷数之差是8.

(1)若t1=15s,则t0~t1阶段的反应速率为v(C)=0.02mol•L-1•min-1.
(2)t4时刻改变的条件为减小压强,B的起始物质的量为2mol.
(3)写出该反应的化学方程式2A(g)+B(g)?3C(g),该反应的逆反应为放热反应(填“吸热反应”或“放热反应”).
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数与Ⅰ处的平衡常数不相等的是Ⅴ(填“Ⅱ”、“Ⅲ”、“Ⅳ”或“Ⅴ”).
(5)在相同条件下,若按下表a、b、c、d四种情况进行投料,达到的平衡与t1时刻的平衡等效(A、B、C的体积分数分别与t1时刻的平衡相同)的是c(填“a”、“b”、“c”或“d”)
| a | b | c | d | |
| n(A)/mol | 2.0 | 1.2 | 2 | 3.6 |
| n(B)/mol | 1.2 | 0.4 | 1 | 1.5 |
| n(c)/mol | 0.1 | 0 | 0.5 | 2 |
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 阳离子就是一个质子 |
(2)画出T的离子结构示意图
 .
.(3)写出实验室制取Y单质的化学方程式2KMnO4$\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)Z的三种同位素原子名称氕、氘、氚.
(5)写出由T、X和Y三种元素组成的一种化合物在水溶液中的电离方程式NaClO=Na++ClO-.
 有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.