题目内容
13. A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.请回答下列问题:
(1)C的基态原子核外电子排布式是1s22s22p63s23p1.
(2)A、B、D的最简单氢化物中,键角由大到小的顺序为SiH4>NH3>H2O(用分子式表示),AB2-离子的立体构型名称为V形.
(3)A与X元素形成的某种化合物晶胞如图,该化合物的化学式为Cu3N,阴离子的配位数是6.
(4)X与B元素能形成X2B和XB两种化合物,试从结构角度解释在高温下XB会分解生成X2B 的原因是Cu2+的价电子排布为3d9,Cu+的价电子排布为3d10,是全充满结构,更稳定.
(5)在高温下,C的硫酸盐与氢气反应可生成三种氧化物,反应的化学方程式是Al2(SO4)3+3H2$\frac{\underline{\;高温\;}}{\;}$Al2O3+3SO2+3H2O.
分析 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分,则A为N元素,B是O元素;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子,原子核外电子排布式为:1s22s22p63s23p1,则C为Al;D的基态原子的M能层中只有1对成对电子和2个未成对电子,原子核外电子排布式为:1s22s22p63s23p2,故D为Si;X元素处于第四周期ⅠB族,则X为Cu.
解答 解:A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分,则A为N元素,B是O元素;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子,原子核外电子排布式为:1s22s22p63s23p1,则C为Al;D的基态原子的M能层中只有1对成对电子和2个未成对电子,原子核外电子排布式为:1s22s22p63s23p2,故D为Si;X元素处于第四周期ⅠB族,则X为Cu.
(1)C 的基态原子核外电子占有7个轨道,但只有1个未成对电子,C的基态原子核外电子排布式是1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
(2)A、B、D的最简单氢化物分别为NH3、H2O、SiH4,分别为三角锥形、V形、正四面体,由排斥作用:孤对电子之间排斥>孤电子对与成键电子对之间排斥>成键电子对之间排斥,故键角由大到小的顺序为:SiH4>NH3>H2O,NO2-离子中N原子孤对电子数为$\frac{5+1-2×2}{2}$=1,价层电子对数为2+1=3,故其立体构型为V形,
故答案为:SiH4>NH3>H2O;V形;
(3)晶胞中Cu原子数目为12×$\frac{1}{4}$=3、N原子数目为8×$\frac{1}{8}$=1,该化合物的化学式为Cu3N,顶点氮离子与棱上的离子相邻,每个顶点为8个晶胞共用,镁条棱为4个晶胞共用,故其配位数为$\frac{8×3}{4}$=6,
故答案为:Cu3N;6;
(4)X与B元素能形成Cu2O和CuO两种化合物,Cu2+的价电子排布为3d9,Cu+的价电子排布为3d10,是全充满结构,更稳定,在高温下CuO会分解生成Cu2O,
故答案为:Cu2+的价电子排布为3d9,Cu+的价电子排布为3d10,是全充满结构,更稳定;
(5)在高温下,硫酸铝与氢气反应可生成三种氧化物,即生成氧化铝、二氧化硫与水,反应的化学方程式是:Al2(SO4)3+3H2$\frac{\underline{\;高温\;}}{\;}$Al2O3+3SO2+3H2O,
故答案为:Al2(SO4)3+3H2$\frac{\underline{\;高温\;}}{\;}$Al2O3+3SO2+3H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、价层电子对互斥理论、晶胞计算等,是对现实综合能力的考查,难度中等.

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
| A. | 在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态 | |
| B. | 在电解质溶液中通入标况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态 | |
| C. | 阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍 | |
| D. | 阳极产生的气体的平均摩尔质量为58g/mol |
Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入BaCl2溶液有白色沉淀生成,再滴加KSCN溶液,上层清液变红,第二支试管加入CCl4,充分振荡静置后溶液分层,下层为无色.
下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
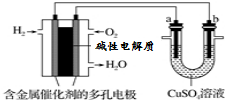
| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
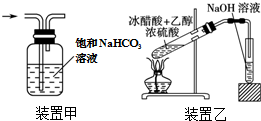
| A. | 将25.0gCuSO4•5H2O溶于100mL蒸馏水,配得1.0mol•L-1硫酸铜溶液 | |
| B. | 焰色反应实验中,在蘸取待测溶液前,先用稀盐酸洗净铂丝并灼烧至火焰为无色 | |
| C. | 用装置甲除去Cl2中的HCl气体 | |
| D. | 用装置乙制取乙酸乙酯 |
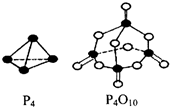 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.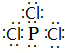 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).