题目内容
8.生活中处处有化学,下列表述不正确的是( )| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
分析 A、甲醛的水溶液俗称福尔马林;
B、聚乙烯塑料无毒;
C、碳酸氢钠能和胃酸盐酸反应;
D、食盐能防止食品腐烂.
解答 解:A、甲醛的水溶液俗称福尔马林,而甲醛有毒,故不能用于食品的防腐,故A错误;
B、聚乙烯塑料无毒,故可以用作食品包装材料,故B正确;
C、碳酸氢钠能和胃酸盐酸反应,且温和刺激性小,故可以治疗胃酸过多,故C正确;
D、食盐能防止食品腐烂,如用食盐来腌制肉、鱼等,也可做调味剂,故D正确.
故选A.
点评 本题考查了绿色化学的概念以及化学物质在生活中的应用,难度不大,应注意的是氢氧化铝和碳酸氢钠能治疗胃酸过多.

练习册系列答案
相关题目
18.能说明氯元素的非金属性比硫元素强的事实是( )
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
19. 某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
 某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )
某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含着任意数目的中间步骤)连接如图所示.( )| A. | 一定有△H1<0 | B. | 一定有△H2<0 | ||
| C. | 一定有△H1<0,△H2>0 | D. | 一定有△H1+△H2=0 |
16.下列操作或装置能达到实验目的是( )
| A | B | C | D |
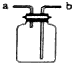 | 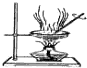 | 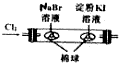 | 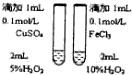 |
| 用该装置排空气法收集H2、CO2、Cl2等气体 | 蒸干AlCl3饱和溶液制备AlCl3晶体 | 可以证明氧化性Cl2>Br2>I2 | 比较不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
3.现取mg镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值ng,则下列有关该说法中不正确的有( )
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
20.下列说法正确的是( )
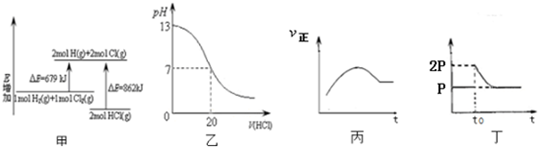

| A. | 图甲表示H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | 图乙表示室温时用0.1 mol/L盐酸滴定20 mL 0.1 mol/LNaOH溶液,溶液pH变化 | |
| C. | 图丙表示向恒容绝热的密闭容器中通入A和B,发生2A (g)+B (g)?2C(g)反应,其正反应速率随时间变化的示意图,则该反应为吸热反应 | |
| D. | 图丁表示在恒温密闭容器中,2BaO2(s)?2BaO(s)+O2(g)达到平衡,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡过程体系压强的变化 |
17.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: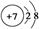 | |
| C. | 氨气分子的电子式: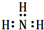 | |
| D. | 对硝基甲苯的结构简式: |
20.已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
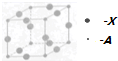 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.