题目内容
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质.某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质.

回答下列问题:
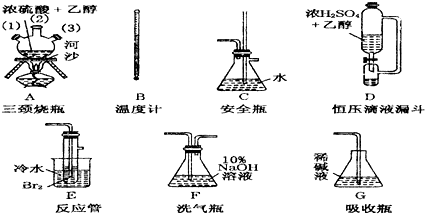
(1)装置A是乙烯的发生装置,图中一处明显的错误是 ,烧瓶中碎瓷片的作用是 .
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入 (填代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通过B装置,然后通入 装置,也可将混合气体干燥后,通入 装置.
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水无明显变化、D后面的石灰水变混浊.请对出现该现象的原因进行合理猜想: .
(4)用离子方程式说明SO2使溴水褪色的原理 .

回答下列问题:
(1)装置A是乙烯的发生装置,图中一处明显的错误是
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水无明显变化、D后面的石灰水变混浊.请对出现该现象的原因进行合理猜想:
(4)用离子方程式说明SO2使溴水褪色的原理
考点:乙醇的消去反应
专题:实验题
分析:(1)温度计的位置取决于所测量的物质;乙醇沸点低,加热容易产生爆沸;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,结合乙烯的结构特点分析解答;
(4)二氧化硫具有还原性通入溴水被氧化剂溴单质氧化为硫酸,据此写出反应的离子方程式.
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,结合乙烯的结构特点分析解答;
(4)二氧化硫具有还原性通入溴水被氧化剂溴单质氧化为硫酸,据此写出反应的离子方程式.
解答:
解:(1)浓硫酸和乙醇制取乙烯时,应严格控制反应物乙醇浓硫酸混合液的温度在170度,所以温度计测量的是混合液的稳定,温度计水银球部分没有插入液面以下;乙醇沸点低,加热时容易发生爆沸,加热碎瓷片可以防止爆沸,
故答案为:温度计水银球部分没有插入反应溶液中;防止液体暴沸;
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在;
乙烯具有还原性能使溴的四氯化碳褪色,干燥的二氧化硫不与溴的四氯化碳反应,将干燥的混合气体直接通入盛有溴的四氯化碳的G中,如果溶液褪色,则证明存在乙烯;
故答案为:C;D;G;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,而乙烯含有不饱和键具有还原性,能被高锰酸钾氧化,
故答案为:乙烯被酸性KMnO4溶液氧化成CO2;
(4)二氧化硫具有还原性通入溴水被氧化剂溴单质氧化为硫酸,反应的离子方程式为:SO2+Br2+2H2O═SO42-+2Br-+4H+,
故答案为:SO2+Br2+2H2O═SO42-+2Br-+4H+.
故答案为:温度计水银球部分没有插入反应溶液中;防止液体暴沸;
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在;
乙烯具有还原性能使溴的四氯化碳褪色,干燥的二氧化硫不与溴的四氯化碳反应,将干燥的混合气体直接通入盛有溴的四氯化碳的G中,如果溶液褪色,则证明存在乙烯;
故答案为:C;D;G;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,而乙烯含有不饱和键具有还原性,能被高锰酸钾氧化,
故答案为:乙烯被酸性KMnO4溶液氧化成CO2;
(4)二氧化硫具有还原性通入溴水被氧化剂溴单质氧化为硫酸,反应的离子方程式为:SO2+Br2+2H2O═SO42-+2Br-+4H+,
故答案为:SO2+Br2+2H2O═SO42-+2Br-+4H+.
点评:本题考查了乙醇的消去反应的实验、乙烯的性质及检验,题目难度中等,注意掌握乙醇发生消去反应原理及乙烯的实验室制法,试题侧重考查学生分析问题,设计实验的能力,明确各种气体的性质是本题解题的关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
一定温度下,在一个容积为1L的密闭容器中,充入1mol H2(g)和1mol I2(g),发生反应H2(g)+I2(g)?2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)?
H2(g)+
I2(g),则下列判断正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、后一反应的平衡常数为1 |
| B、后一反应的平衡常数为0.5 |
| C、后一反应达到平衡时,H2的平衡浓度为0.25mol?L-1 |
| D、后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol?L-1 |
满足通式CnH2nO的有机物甲,既可被氧化为一元羧酸乙,又可被还原为一元醇丙,乙和丙在一定条件下反应生成酯丁,则下列说法正确的是( )
| A、甲和丁的最简式相同 |
| B、丁的分子量是丙的两倍 |
| C、甲既可是饱和一元醛,又可是饱和一元酮 |
| D、甲的分子中一定具有甲基 |
对实验I-IV的实验现象预测错误的是( )
A、 继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
B、 实验试管中出现淡黄色浑浊 |
C、 实验中碳棒上有无色气泡产生 |
D、 实验中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
下列实验操作中正确的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球插入液面以下 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |