题目内容
6.有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )| 方案 | 操作 | 判断 |
| A | 分别加入澄清石灰水 | 产生沉淀者为Na2CO3 |
| B | 分别加入等浓度的稀盐酸 | 反应较剧烈者为Na2CO3 |
| C | 分别加入CaCl2溶液 | 产生沉淀者为Na2CO3 |
| D | 逐渐加入等浓度的盐酸 | 立即产生气泡者为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 NaHCO3不稳定,加热易分解,但加热溶液不分解,都可与碱发生反应,与氢氧化钙溶液反应都可生成沉淀,且都能与酸反应生成气体,以此解答该题.
解答 解:A.碳酸钠和碳酸氢钠均与Ca(OH)2反应产生沉淀,故Ca(OH)2溶液比较是否有沉淀生成的方法不能鉴别二者,故A错误;
B.向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,则迅速产生气体,产生气体较为剧烈的为碳酸氢钠,故B错误;
C.碳酸钠与氯化钙反应产生碳酸钙沉淀,碳酸氢钠与氯化钙不反应,故氯化钙溶液可以区分两物质,故C正确;
D.向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,则迅速产生气体,故D错误.
故选C.
点评 本题考查Na2CO3和NaHCO3的鉴别,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意把握二者性质的差异,学习中注意相关知识的积累.

练习册系列答案
相关题目
16.下列试剂常用来检验Fe3+的是( )
| A. | 氯水 | B. | BaCl2溶液 | C. | KSCN溶液 | D. | KNO3溶液 |
17.某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应:X(g)+mY (g)?3Z(g)△H<0,平衡时,X和Y的转化率都是10%.下列叙述不正确的是( )
| A. | m=2 | |
| B. | 达平衡时,Z的体积分数为10% | |
| C. | 达平衡后,保持容器体积不变,加热,容器内压强将增大 | |
| D. | 将平衡后的容器体积压缩至1L,X的浓度为0.45mol•L-1 |
14.在一定温度下,向一容积不变的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | B. | 化学反应速率关系是:2υ正(X)=υ正(Y) | ||
| C. | 容器内气体密度不随时间变化 | D. | 容器内X、Y、Z的浓度之比为l:2:2 |
11.对于可逆反应A(g)+3B(s)?2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
18.某有机物M的结构简式为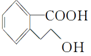 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )
 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
14.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
CO(s)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0KJ•mol-1
则煤气化主要反应C(s)+H2O (g)═CO(g)+H2(g)的△H=+131.3 kJ/mol
(2)已知CO(g)+O2(g)═CO2(g)+O(g)的正反应速率为v正=k正•c(CO)•c(O2),逆反应速率为v逆=k逆•c(CO2)•c(O),k为速率常数.2500K时,k正=1.21×105 L/mol,k逆=3.02×105L/mol,则该温度下的反应平衡常数K=0.40
(3)甲醇制甲醚的有关反应为:2CH3OH (g)═CH3OCH 3(g)+H2O (g).一定温度下,在三个容积均为1.0L的恒容密闭容器中发生该反应.
①x/y=$\frac{1}{2}$
②已知387℃时该反应的化学平衡常数K=4.该温度下,若起始时向容器Ⅰ中冲入0.10molCH3OH (g)、0.15mol CH3OCH3(g)和0.10mol H2O(g),则反应将向正(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为B.(填序号)
A.升高温度
B.降低温度
C.其他条件不变,增加CH3OH 的物质的量
D.保持其他条件不变,通入氖气
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示.
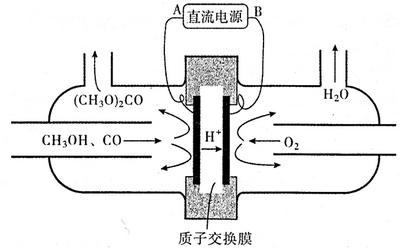
则电源的负极为B(填“A”或“B”),写出阳极的电极反应式:2CH3OH+CO-2e-=(CH3O)2CO+2H+
(5)将化石燃料的燃烧产物CO2通入NaOH溶液中可制得碳酸氢钠.取0.2mol/L碳酸钠溶液与0.2mol/L氯化钡溶液等体积混合产生浑浊,请结合一下数据,通过计算说明产生浑浊的原因:[已知:25℃时,0.1mol/L碳酸氢钠溶液中碳酸根离子的浓度为0.0011mol/L,Ksp(BaCO3)=5.1×10-9].
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
CO(s)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0KJ•mol-1
则煤气化主要反应C(s)+H2O (g)═CO(g)+H2(g)的△H=+131.3 kJ/mol
(2)已知CO(g)+O2(g)═CO2(g)+O(g)的正反应速率为v正=k正•c(CO)•c(O2),逆反应速率为v逆=k逆•c(CO2)•c(O),k为速率常数.2500K时,k正=1.21×105 L/mol,k逆=3.02×105L/mol,则该温度下的反应平衡常数K=0.40
(3)甲醇制甲醚的有关反应为:2CH3OH (g)═CH3OCH 3(g)+H2O (g).一定温度下,在三个容积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.该温度下,若起始时向容器Ⅰ中冲入0.10molCH3OH (g)、0.15mol CH3OCH3(g)和0.10mol H2O(g),则反应将向正(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为B.(填序号)
A.升高温度
B.降低温度
C.其他条件不变,增加CH3OH 的物质的量
D.保持其他条件不变,通入氖气
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示.

则电源的负极为B(填“A”或“B”),写出阳极的电极反应式:2CH3OH+CO-2e-=(CH3O)2CO+2H+
(5)将化石燃料的燃烧产物CO2通入NaOH溶液中可制得碳酸氢钠.取0.2mol/L碳酸钠溶液与0.2mol/L氯化钡溶液等体积混合产生浑浊,请结合一下数据,通过计算说明产生浑浊的原因:[已知:25℃时,0.1mol/L碳酸氢钠溶液中碳酸根离子的浓度为0.0011mol/L,Ksp(BaCO3)=5.1×10-9].