题目内容
1.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10) 三种物质中,下列说法正确的是( )| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
分析 化学式结构组成相似的难溶物,Ksp越小,溶解度越小;化学式结构组成不相似的,不能直接比较,要根据Ksp求出其浓度,再比较溶解度大小;当Qc>Ksp时,可以实现沉淀的转化,据此进行解答.
解答 解:A.当Qc>Ksp[Mg(OH)2]时,Mg(OH)2可以转化为Ca(OH)2,故A错误;
B.由Ca(OH)2与Mg(OH)2化学式结构组成相似,而且Ca(OH)2的Ksp大于Mg(OH)2的Ksp,所以氢氧化镁的溶解度小;
c[Mg(OH)2]=c(Mg2+)=$\root{3}{\frac{1.2×1{0}^{-11}}{4}}$=$\root{3}{3}$×10-3mol/L,c(AgCl)=c(Ag+)=$\sqrt{1.56×1{0}^{-10}}$=$\sqrt{1.56}$×10-5mol/L,所以AgCl的溶解度比Mg(OH)2的溶解度小,故B错误;
C.Mg(OH)2更难溶,微溶物Ca(OH)2可以转化为更难溶的Mg(OH)2,故C错误;
D.化学式结构组成不相似的难溶物,不能直接根据Ksp比较溶解度大小,则Ksp越大,S不一定越大,故D正确;
故选D.
点评 本题考查难溶物溶解平衡及沉淀转化的本质,题目难度中等,明确溶度积的概念及表示的意义为解答关键,试题培养了学生的分析能力及综合应用能力.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 氢氟酸、浓硝酸、硅酸钠溶液依次保存在棕色玻璃瓶、无色细口瓶、带胶塞细口瓶中 | |
| B. | 钠着火时不能用泡沫灭火器灭火 | |
| C. | 用饱和碳酸钠溶液除去CO2中混有的HCl | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
16.下列各项中表达正确的是( )
| A. | F原子结构示意图: | B. | 次氯酸电子式H Cl O | ||
| C. | H、D、T表示同一种核素 | D. | CO2的结构式为O═C═O |
6.下列离子方程式正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
13.M是一种化工原料,可以制备一系列物质(见如图).
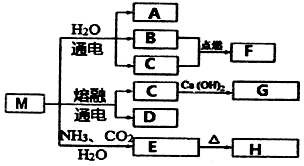
下列说法正确的是( )

下列说法正确的是( )
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |
10.下列说法准确的是( )
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |