题目内容
16.下列各项中表达正确的是( )| A. | F原子结构示意图: | B. | 次氯酸电子式H Cl O | ||
| C. | H、D、T表示同一种核素 | D. | CO2的结构式为O═C═O |
分析 A、氟原子的核内有9个质子,核外有9个电子;
B、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合;
C、具有一定质子数和中子数的原子就是一种核素;
D、CO2分子中碳原子最外层有4个电子,形成4个共价键;氧原子最外层有6个电子,形成2个共价键.
解答 解:A、氟原子的核内有9个质子,核外有9个电子,故F原子的结构示意图为 ,故A错误;
,故A错误;
B、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故电子式为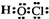 ,故B错误;
,故B错误;
C、H、D、T为氢元素的3种不同核素,它们之间互为同位素,故C错误;
D、CO2分子中碳原子最外层有4个电子,形成4个共价键;氧原子最外层有6个电子,形成2个共价键,故碳原子和氧原子间形成双键,结构式为O═C═O,故D正确;
故选D.
点评 本题考查了原子结构示意图、电子式的书写和结构式等问题,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
6.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |
4.下列表示对应化学反应的离子方程式,正确的是( )
| A. | FeCl3溶液和Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 醋酸溶液水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NO2与氢氧化钠的反应:3NO2+2OH-═NO3-+NO2-+2H2O | |
| D. | 向NaAlO2溶液中通入过量SO2:2AlO2-+SO2+3H2O═2A(OH)3↓+SO32- |
11.下列说法不正确的是( )
| A. | 生活中使用的漂白粉和肥皂都是混合物 | |
| B. | 烟、雾、豆浆、有色玻璃都是胶体 | |
| C. | 汽油属于混合物,而液氯、冰醋酸均属于纯净物 | |
| D. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
1.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10) 三种物质中,下列说法正确的是( )
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
8.将某溶液逐滴加入Fe(OH)3胶体内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2mol/L NaOH溶液 | B. | 2mol/LH2SO4溶液 | C. | 2mol/LMgSO4溶液 | D. | FeCl3溶液 |
5.下列有关有机物说法不正确的是( )
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯(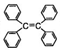 )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol 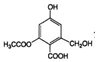 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |