题目内容
6.下列离子方程式正确的是( )| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.铝离子的水解为可逆反应,应该用可逆号;
C.硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵;
D.碳酸氢钙少量,反应生成碳酸钙沉淀、碳酸钠和水.
解答 解:A.FeCl2溶液中通入Cl2,二者发生氧化还原反应,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.AlCl3溶液中,铝离子部分水解生成氢氧化铝和氯化氢,溶液呈酸性,正确的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故B错误;
C.Al2(SO4)3溶液加入过量的氨水,反应生成氢氧化铝沉淀和硫酸铵,反应的离子方程式为:Al3++3 NH3•H2O=Al(OH)3↓+3NH4+,故C正确;
D.NaOH溶液中滴加少量Ca(HCO3)2溶液,反应生成碳酸钙、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
16.已知:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O.其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6mol•L-1)反应,MnO2需和浓盐酸(>8mol•L-1)反应.根据以上信息,下列结论中不正确的是( )
| A. | 上述反应均属于氧化还原反应 | |
| B. | 生成1 mol Cl2时,三个反应中转移的电子数相等 | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
14.下图装置或操作正确的是( )
| A. |  用装置量取 15.00ml 的 NaOH 溶液 | |
| B. |  用装置制备 Cl2 | |
| C. |  装置用于除去 CO2中的HCl | |
| D. |  关闭活塞 a,从 b处加水,以检查装置的气密性 |
1.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10) 三种物质中,下列说法正确的是( )
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
11.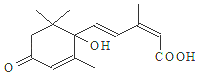 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
18.下列说法正确的是( )
| A. | 容量瓶和分液漏斗使用前必须要检漏、干燥 | |
| B. | 可以用酒精萃取溶解在水中的碘 | |
| C. | 新制氯水应保存在棕色细口瓶中 | |
| D. | 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+ |
15.某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板.他们对蚀刻银的过程进行了探究.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
(2)选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证c(Fe3+)相等.
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
【实验结论与讨论】铁盐能蚀刻银;NO3-能提高铁盐的蚀刻能力.推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
| 实验方案 | 预期现象和结论 |