题目内容
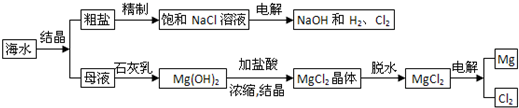
从海水制备金属镁的流程如图所示:

(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式: ; .
(2)向石灰乳中加入MgCl2溶液,充分搅拌、过滤、洗涤.写出该反应的化学方程式: .
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有 .

(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:
(2)向石灰乳中加入MgCl2溶液,充分搅拌、过滤、洗涤.写出该反应的化学方程式:
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有
考点:海水资源及其综合利用,金属冶炼的一般原理
专题:元素及其化合物
分析:(1)碳酸钙在高温条件下分解生成CaO与二氧化碳,氧化钙和水会生成氢氧化钙;
(2)氢氧化钙和氯化镁反应会生成氢氧化镁沉淀和氯化钙;
(3)与组成合金的各组分金属相比,合金具有硬度较大、熔点较低的特点.
(2)氢氧化钙和氯化镁反应会生成氢氧化镁沉淀和氯化钙;
(3)与组成合金的各组分金属相比,合金具有硬度较大、熔点较低的特点.
解答:
解:(1)贝壳的主要成份是碳酸钙,碳酸钙在高温条件下分解生成CaO与二氧化碳,可以制备氧化钙,反应方程式为:CaCO3
CaO+CO2↑,氧化钙和水反应会生成氢氧化钙:CaO+H2O=Ca(OH)2,
故答案为:CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2;
(2)氢氧化钙和氯化镁发生复分解反应:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,生成氢氧化镁沉淀和氯化钙,
故答案为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(3)合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属,④合金的硬度大,熔点低,所以从熔点与硬度方面来看,镁合金与镁相比较,其特点有熔点低,硬度大,
故答案为:熔点低,硬度大.
| ||
故答案为:CaCO3
| ||
(2)氢氧化钙和氯化镁发生复分解反应:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,生成氢氧化镁沉淀和氯化钙,
故答案为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(3)合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属,④合金的硬度大,熔点低,所以从熔点与硬度方面来看,镁合金与镁相比较,其特点有熔点低,硬度大,
故答案为:熔点低,硬度大.
点评:本题考查了从海水中提取镁的原理和方法,侧重考查石灰乳的制备以及石灰乳中加入MgCl2溶液的反应,题目难度不大,注意合金的特点.

练习册系列答案
相关题目
关于小苏打水溶液的表述正确的是( )
| A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、HCO3-的电离程度大于HCO3-的水解程度 |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离只有:NaHCO3=Na++HCO3- |
NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A、室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C、50℃时,pH=1的1.0L H2SO4溶液中含有的H+数目为0.1 NA |
| D、3.4g NH3中含N-H键数目为0.2NA |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA |
| B、足量的硫单质与64g铜完全反应,转移电子数目为NA |
| C、1 mol Fe与足量的稀HNO3反应,转移2NA个电子 |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |

 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水. 现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示:
现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示: