题目内容
10.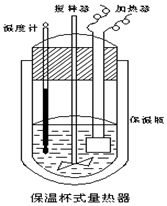 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
分析 A、先根据溶液反应放出的热量Q=-cm△T+150.5J•0C-1×△T,再根据中和热△H=-$\frac{Q}{n(H{\;}_{2}O)}$计算即可;
B、若量热计的保温瓶绝热效果不好,则会损失一部分热量;
C、CH3COOH溶液与NaOH溶液的反应为中和反应为放热反应;
D、酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差.
解答 解:A.温度差△t=27.7℃-25.0℃=2.7℃,Q=cm△t=2.7×4.184J•g-1•℃-1×200g+150.5J•℃-1×2.7℃=2665.71J=2.67kJ,△H=-$\frac{Q}{n(H{\;}_{2}O)}$=-$\frac{2.67kJ}{0.05mol}$=-53.3 kJ/mol,故A正确;
B.若量热计的保温瓶绝热效果不好,则会损失一部分热量,则测出放出的偏少,△H为负值,故偏大,故B正确;
C.CH3COOH溶液与NaOH溶液的反应为中和反应为放热反应,故C错误;
D.酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和,故D正确;
故选C.
点评 本题考查中和热的测定,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.下列说法错误的是( )
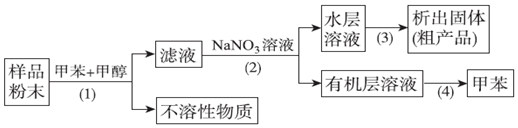

| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
1.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,则下列说法正确的是( )
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
18.化学源于生活,又髙于生活.下列说法正确的是( )
| A. | 绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 高纯度的晶体桂可以制备晶体管等半导体、电脑芯片 | |
| D. | 酒精、NaCl溶液、CuSO4溶液、浓HNO3都可使蛋白质发生变性 |
5.某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1mol•L-1,则Cl-的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |
2.下列实验报告记录的实验现象正确的是( )
| 实验 | 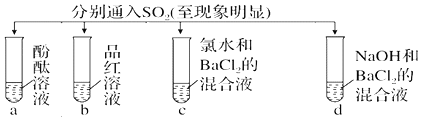 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
19.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 在常温常压下,2.24L NH3与1.8g H2O,所含的质子数均为NA | |
| B. | 在常温常压下,1mol Cl2与足量的NaOH溶液完全反应,转移电子2NA | |
| C. | 在标准状况下,64g SO2 中含有的原子数为3NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molBaCl2中含有的氯离子数为NA | |
| B. | 1mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有的氢分子数为0.5NA | |
| D. | 16gO3中含有的氧原子数为NA |