题目内容
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1molBaCl2中含有的氯离子数为NA | |
| B. | 1mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有的氢分子数为0.5NA | |
| D. | 16gO3中含有的氧原子数为NA |
分析 A.1mol氯化钡含有2mol氯离子;
B.1个镁原子含有12个电子;
C.常温常压Vm大于22.4L/mol;
D.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 解:A.1mol氯化钡含有2mol氯离子,个数为2NA,故A错误;
B.1个镁原子含有12个电子,1mol镁原子中含有的电子数为12NA,故B错误;
C.常温常压Vm大于22.4L/mol,Vm未知,无法计算氢气分子数,故C错误;
D.臭氧是由氧原子构成,所以16gO3中含有的氧原子数为$\frac{16g}{16g/mol}$×NA=NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,侧重考查物质所含微粒数目的计算,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
10.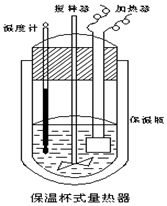 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
15.进行化学实验时必须注意实验安全.下列实验操作合理的是( )
| A. | 为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜 | |
| B. | 进行SO2性质探究实验时,多余的SO2应排到实验室外 | |
| C. | 为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒入垃圾箱 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,然后边搅拦边慢慢加入浓H2SO4 |
12.能正确表示下列反应的离子方程式的是( )
| A. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| B. | 硫酸铜与烧碱反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 苯酚与碳酸钠反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| D. | 碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
19. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )| A. | 碳酸钠溶液 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
16.电解质是( )
| A. | 在水溶液里或溶融状态下全部电离的化合物 | |
| B. | 在水溶液里或熔融状态下能导电的化合物 | |
| C. | 可溶性盐类 | |
| D. | 导电性很强的物质 |
17.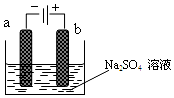 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )| A. | a电极附近呈红色,b电极附近无明显变化 | |
| B. | 逸出气体的体积,a电极的大于b电极的 | |
| C. | Na2SO4水溶液浓度逐渐增大 | |
| D. | 当电路中通过0.04mol e-时,a电极逸出气体的体积为448mL |