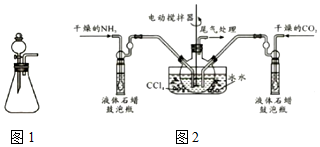
题目内容
2.下列实验报告记录的实验现象正确的是( )| 实验 | 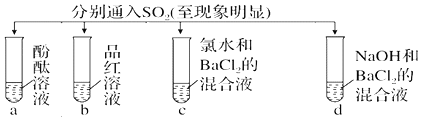 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
分析 二氧化硫为酸性氧化物,具有漂白性、还原性,以此来解答.
解答 解:二氧化硫与水反应生成亚硫酸,遇酚酞为无色;
二氧化硫具有漂白性,能使品红褪色,最终为无色;
二氧化硫与氯水发生氧化还原反应生成硫酸,且硫酸与氯化钡反应生成硫酸钡白色沉淀,溶液为无色;
二氧化硫与NaOH反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成亚硫酸钡白色沉淀,
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
12.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、SO42-、Cl-、NH4+ |
13.下列有关物质分类或归纳不正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:氯化钡、硝酸、碱石灰、硫酸铜
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:氯化钡、硝酸、碱石灰、硫酸铜
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
10.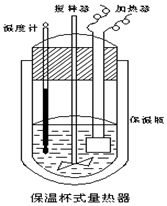 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
17.某物质 R是人类生命不可缺少的物质.已知 R的摩尔质量为 150g/mol,其中含碳元素 40%,含氢元素 6.7%,其余为氧元素.则 R的化学式为( )
| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
7.常温下,在溶液中可发生以下反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O,②2M2++R2═2M3++2R-,③2R-+Z2═R2+2Z-,由此判断下列说法错误的是( )
| A. | 常温下反应2M2++Z2═2M3++2Z-可以发生 | |
| B. | Z元素在反应①中被还原,在③中被氧化 | |
| C. | 氧化性强弱顺序为:XO4->Z2>R2>M3+ | |
| D. | 还原性强弱顺序为:X2+<Z-<R-<M2+ |
14.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 1mol/L的氯化铁溶液中,若Cl-的数目为3NA,则Fe3+的数目为NA | |
| C. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol,当放出热量9.2 kJ时,转移电子0.6 NA | |
| D. | 标准状况下,11.2L三氯甲烷中含有含极性共价键数目为1.5NA |
19. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥红纸条c不褪色;若关闭活塞b,则c不久褪色.则a溶液(足量)是( )| A. | 碳酸钠溶液 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |