题目内容
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素是第二周期中原子半径最小的元素,C2-比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子.
(1)B元素的符号是 .
(2)画出D原子和C2-的结构示意图 .
(3)将B元素形成的单质通入水中反应的化学方程式为 ,B、C、D三种元素形成的氢化物中稳定性最强的是 ,最高价氧化物的水化物酸性最强的是 .
(1)B元素的符号是
(2)画出D原子和C2-的结构示意图
(3)将B元素形成的单质通入水中反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,说明A最外层有2个电子,A的氧化物的化学式为AO,0.4g A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应,根据A的化合价可知,每摩尔A的氧化物可以和2mol盐酸反应,所以A的氧化物的物质的量为0.01mol,故可求得A的氧化物的相对原子质量为
=40,所以A的相对原子质量为40-16=24,A原子核内质子数目与中子数目相等,所以A为镁元素,B元素是第二周期中原子半径最小的元素,则B为氟元素,C2-比A元素的离子多1个电子层,所以C为硫元素,D元素的原子核外L层比K层多2个电子,则D为碳元素,据此答题.
| 0.4 |
| 0.01 |
解答:
解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,说明A最外层有2个电子,A的氧化物的化学式为AO,0.4g A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应,根据A的化合价可知,每摩尔A的氧化物可以和2mol盐酸反应,所以A的氧化物的物质的量为0.01mol,故可求得A的氧化物的相对原子质量为
=40,所以A的相对原子质量为40-16=24,A原子核内质子数目与中子数目相等,所以A为镁元素,B元素是第二周期中原子半径最小的元素,则B为氟元素,C2-比A元素的离子多1个电子层,所以C为硫元素,D元素的原子核外L层比K层多2个电子,则D为碳元素,
(1)根据上面的分析可知,B为F元素,故答案为:F;
(2)碳原子的结构示意图为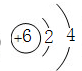 ,S2-的结构示意图为
,S2-的结构示意图为 ,故答案为:
,故答案为: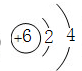 、
、 ;
;
(3)氟气通入水中反应的化学方程式为2F2+2H2O=4HF+O2,由于F元素的非金属性最强,S元素次之,所以在F、S、C三种元素形成的氢化物中稳定性最强的是HF,由于F没有最高价氧化物的水化物,所以酸性最强的是H2SO4,
故答案为:2F2+2H2O=4HF+O2;HF;H2SO4.
| 0.4 |
| 0.01 |
(1)根据上面的分析可知,B为F元素,故答案为:F;
(2)碳原子的结构示意图为
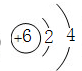 ,S2-的结构示意图为
,S2-的结构示意图为 ,故答案为:
,故答案为: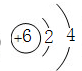 、
、 ;
; (3)氟气通入水中反应的化学方程式为2F2+2H2O=4HF+O2,由于F元素的非金属性最强,S元素次之,所以在F、S、C三种元素形成的氢化物中稳定性最强的是HF,由于F没有最高价氧化物的水化物,所以酸性最强的是H2SO4,
故答案为:2F2+2H2O=4HF+O2;HF;H2SO4.
点评:本题主要考查了原子结构示意图、元素周期律、元素化合物知识等知识点,难度不大,解题的关键在于元素推断,本题的难点是根据计算推断元素种类.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
某元素在化学反应中由化合态变为游离态,则该元素( )
| A、一定被氧化 |
| B、一定被还原 |
| C、既可能被氧化,也可能被还原 |
| D、以上都不是 |
一定温度下,在固定容积的密闭容器中充入2molA和1molB发生反应2A(g)+B(g)=3C(g),达到平衡后,C的体积分数为C%,在相同条件下,按下列情况充入物质达到平衡时,C的体积分数也为C%的是( )
| A、1molA 2molC |
| B、4mol C |
| C、2molA 3molC |
| D、1molA 1molB |
 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.