题目内容
一定质量的铜与足量的氧气反应,消耗了氧气8g,将生成的氧化铜用足量的氢气还原,则反应中消耗氢气的物质的量为多少?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应:2Cu+O2
2CuO、H2+CuO
Cu+H2O,纵观整个过程,氧气获得电子为氢气提供电子,消耗氢气即为8g氧气消耗的氢气,根据n=
计算8g氧气物质的量,结合电子转移守恒计算消耗氢气物质的量.
| ||
| ||
| m |
| M |
解答:
发生反应:2Cu+O2
2CuO、H2+CuO
Cu+H2O,纵观整个过程,氧气获得电子为氢气提供电子,消耗氢气即为8g氧气消耗的氢气,8g氧气物质的量=
=0.5mol,由电子转移守恒,可知消耗氢气物质的量=
=1mol,
答:反应中消耗氢气的物质的量为1mol.
| ||
| ||
| 8g |
| 16g/mol |
| 0.5mol×4 |
| 2 |
答:反应中消耗氢气的物质的量为1mol.
点评:本题考查化学方程式的有关计算,难度不大,明确发生的反应是关键,也可以利用关系式进行计算.

练习册系列答案
相关题目
已知某元素最高价氧化物的对应水化物的化学式为H2XO3则其氢化物为( )
| A、H4X |
| B、XH4 |
| C、HX |
| D、H2X |
下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
| A、CO2和SO2 |
| B、CH4和SiO2 |
| C、BF3和NH3 |
| D、HCl和HI |
0.6mol的Cu2S与足量的稀HNO3反应,生成物为Cu(NO3)2、H2SO4、NO、H2O,则参加反应的被还原和未被还原的硝酸的物质的量分别为( )
| A、0.6mol、0.3mol |
| B、1.2mol、0.6mol |
| C、2mol、0.6mol |
| D、2mol、2.4mol |
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的含两种元素的化合物.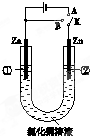 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接. NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0