题目内容
4. 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.(1)获得硫酸铜:该小组同学利用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜,写出该反应的离子方程式:Cu+2H++H2O2═Cu2++2H2O.
(2)制备氧化铜:
粗CuSO4溶液(含有硫酸铁杂质)$\stackrel{步骤Ⅰ}{→}$纯CuSO4溶液$\stackrel{步骤Ⅱ}{→}$CuSO4•5H2O→…→CuO
已知:pH≥6.4时Cu(OH)2沉淀完全,而在pH=3~4时Fe(OH)3即能完全沉淀.
①步骤Ⅰ的目的是除去硫酸铁,可慢慢加入下列某些物质,搅拌,以控制溶液pH=3.5.加热煮沸一段时间,过滤,用稀硫酸酸化滤液至PH=1.下列物质有利于控制溶液PH=3.5的是AC.
A.Cu2(OH)2CO3粉末 B.Fe2O3粉末
C.Cu(OH)2固体 D.NaOH固体
②步骤Ⅱ的目的是得到CuSO4•5H2O固体,操作是蒸发浓缩、冷却结晶、过滤、水浴加热烘干.水浴加热的特点是受热更均匀,温度不会超过100℃.
(3)探究氧化铜的性质
探究氧化铜是否能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较.用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| KClO3质量 | 1.2g | 1.2g | 1.2g |
| 其他物质质量 | 无其他物质 | CuO 0.5g | MnO2 0.5g |
| 待测数据 |
②如何检查该装置的气密性:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气.
③为探究CuO在实验Ⅱ中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,b.CuO的化学性质有没有改变.
分析 (1)用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,反应物为Cu、H2SO4、H2O2,发生氧化还原反应生成硫酸铜和水;
(2)①粗CuSO4溶液(含有硫酸铁杂质),步骤Ⅰ通过调节溶液PH=3.5,除去硫酸铁(三价铁离子),所加试剂能与氢离子反应使铁离子水解平衡正向移动且不引入新的杂质;
②对CuSO4溶液进行蒸发浓缩、冷却结晶,得到CuSO4•5H2O固体;水浴加热使受热更均匀,温度不会超过100℃;
(3)①实验的目的是:证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,上述实验中已有数据KClO3质量和其它物质质量,要比较催化效果就是看使用氧化铜与二氧化锰哪一种产生相同体积气体时所需时间短,或在相同时间内,哪一种物质产生的气体多;
②图中装置有量气管,根据连通器原理检查气密性;
③催化剂的特点是:能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变.
解答 解:(1)用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,反应物为Cu、H2SO4、H2O2,发生氧化还原反应生成硫酸铜和水,反应为Cu+H2SO4+H2O2-CuSO4+H2O,化合价变化为:Cu(0→+2)、H2O2中O(-1→0),所以最小公倍数为2,根据原子守恒,方程式为:Cu+H2SO4+H2O2═CuSO4+2H2O,离子方程式为:Cu+2H++H2O2═Cu2++2H2O,
故答案为:Cu+2H++H2O2═Cu2++2H2O;
(2)①粗CuSO4溶液(含有硫酸铁杂质),步骤Ⅰ通过调节溶液PH=3.5,除去硫酸铁(三价铁离子),Cu2(OH)2CO3与Cu(OH)2固体粉末都能与氢离子反应使铁离子水解平衡正向移动,使Fe3+水解全部转化为Fe(OH)3沉淀,Fe2O3粉末与氢离子反应仍生成三价铁离子,NaOH固体会将铜离子也沉淀下来,
故答案为:AC;
②对CuSO4溶液进行蒸发浓缩、冷却结晶,得到CuSO4•5H2O固体;水浴加热使受热更均匀,温度不会超过100℃,可以防止硫酸铜晶体失去结晶水,
故答案为:蒸发浓缩、冷却结晶;受热更均匀,温度不会超过100℃;
(3)①本题三次实验,提供的KClO3质量均为1.2g,实验Ⅰ的作用为:在不加催化剂的条件下产生氧气的速度与Ⅱ加CuO0.5g以及和Ⅲ加MnO20.5g的效果作对照.Ⅱ、Ⅲ加等质量不同的催化剂比较催化效果,比较催化效果方法一:看产生相同体积气体哪组所需时间短,方法二相同时间内,哪一组产生的气体多,该题题干要求:实验时均以生成25mL气体为准,所以上述实验中的“待测数据”指产生25mL气体所需时间,
故答案为:产生25mL气体所需时间;
②图中装置有量气管,检查气密性时可上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气,
故答案为:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气,
③探究CuO在实验Ⅱ中是否起催化作用,根据催化剂的性质,从它的质量和化学性质角度探究,故答案为:检测CuO反应前后质量是否改变.
点评 本题考查铜及其化合物的性质实验,综合性较强,需要扎实的基础知识和较强的实验探究能力,难度中等.

| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化成溶解度更小的沉淀 | |
| C. | 25℃时,在饱和AgCl、AgI、Ag2S溶液中所含c(Ag+)不同 | |
| D. | AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
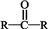 )( )
)( )| A. | CH3OH | B. | 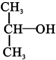 | C. | 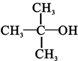 | D. | 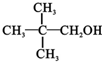 |
| A. | 二氧化碳的结构式:O-C-O | B. | 羟基的电子式为: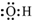 | ||
| C. | 丙烷分子的球棍模型: | D. | 硫离子的结构示意图: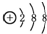 |
| A. | 原子核内有8个中子的碳原子${\;}_{8}^{14}$C | |
| B. | 基态氧原子核外电子的轨道表示式: | |
| C. | HClO的结构式为H-Cl-O | |
| D. | Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |

 .
.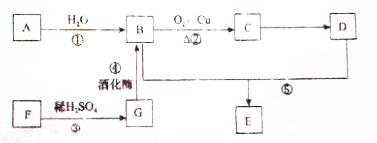
 探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质:
探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质: