题目内容
16.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )| A. | 二氧化碳的结构式:O-C-O | B. | 羟基的电子式为: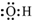 | ||
| C. | 丙烷分子的球棍模型: | D. | 硫离子的结构示意图: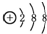 |
分析 A.二氧化碳分子中含有两个碳氧双键;
B.羟基中的氧原子含有一个未成对电子;
C.丙烷分子中含有两个甲基、1个亚甲基,据此判断其球棍模型;
D.硫离子的核电荷数为16,核外电子总数为18,最外层含有8个电子,圆圈表示原子核,圆圈内应标出质子数.
解答 解:A.二氧化碳为共价化合物,分子中含有2个碳氧双键,其正确的结构式为:O=C=O,故A错误;
B.氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,电子式为 ,故B错误;
,故B错误;
C.丙烷分子中含有两个甲基和1个亚甲基,碳原子半径大于氢离子,则丙烷的球棍模型为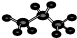 ,故C正确;
,故C正确;
D.硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及结构式、电子式、球棍模型、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
20.阿伏加德罗常数是物理学和化学中的一个重要常量.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,25.5g NH3所含的原子数为6NA | |
| C. | 标准状况下,11.2L水所含的分子数为0.5NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
7.下列说法不正确的是( )
| A. | 锅炉水垢用Na2CO3溶液浸泡一段时间后,可用盐酸溶解 | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,固体颜色变深 | |
| C. | NaH2PO4溶液显酸性,Na2HPO4溶液显碱性,两种溶液中都有电离平衡和水解平衡 | |
| D. | 等物质的量浓度的(NH4)2CO3,(NH4)2SO4,(NH4)2Fe(SO4)2三种溶液,NH${\;}_{4}^{+}$浓度相等 |
4. 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
(1)获得硫酸铜:该小组同学利用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜,写出该反应的离子方程式:Cu+2H++H2O2═Cu2++2H2O.
(2)制备氧化铜:
粗CuSO4溶液(含有硫酸铁杂质)$\stackrel{步骤Ⅰ}{→}$纯CuSO4溶液$\stackrel{步骤Ⅱ}{→}$CuSO4•5H2O→…→CuO
已知:pH≥6.4时Cu(OH)2沉淀完全,而在pH=3~4时Fe(OH)3即能完全沉淀.
①步骤Ⅰ的目的是除去硫酸铁,可慢慢加入下列某些物质,搅拌,以控制溶液pH=3.5.加热煮沸一段时间,过滤,用稀硫酸酸化滤液至PH=1.下列物质有利于控制溶液PH=3.5的是AC.
A.Cu2(OH)2CO3粉末 B.Fe2O3粉末
C.Cu(OH)2固体 D.NaOH固体
②步骤Ⅱ的目的是得到CuSO4•5H2O固体,操作是蒸发浓缩、冷却结晶、过滤、水浴加热烘干.水浴加热的特点是受热更均匀,温度不会超过100℃.
(3)探究氧化铜的性质
探究氧化铜是否能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较.用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见表:
①上述实验中的“待测数据”指产生25mL气体所需时间.
②如何检查该装置的气密性:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气.
③为探究CuO在实验Ⅱ中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,b.CuO的化学性质有没有改变.
 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.(1)获得硫酸铜:该小组同学利用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜,写出该反应的离子方程式:Cu+2H++H2O2═Cu2++2H2O.
(2)制备氧化铜:
粗CuSO4溶液(含有硫酸铁杂质)$\stackrel{步骤Ⅰ}{→}$纯CuSO4溶液$\stackrel{步骤Ⅱ}{→}$CuSO4•5H2O→…→CuO
已知:pH≥6.4时Cu(OH)2沉淀完全,而在pH=3~4时Fe(OH)3即能完全沉淀.
①步骤Ⅰ的目的是除去硫酸铁,可慢慢加入下列某些物质,搅拌,以控制溶液pH=3.5.加热煮沸一段时间,过滤,用稀硫酸酸化滤液至PH=1.下列物质有利于控制溶液PH=3.5的是AC.
A.Cu2(OH)2CO3粉末 B.Fe2O3粉末
C.Cu(OH)2固体 D.NaOH固体
②步骤Ⅱ的目的是得到CuSO4•5H2O固体,操作是蒸发浓缩、冷却结晶、过滤、水浴加热烘干.水浴加热的特点是受热更均匀,温度不会超过100℃.
(3)探究氧化铜的性质
探究氧化铜是否能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较.用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| KClO3质量 | 1.2g | 1.2g | 1.2g |
| 其他物质质量 | 无其他物质 | CuO 0.5g | MnO2 0.5g |
| 待测数据 |
②如何检查该装置的气密性:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气.
③为探究CuO在实验Ⅱ中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,b.CuO的化学性质有没有改变.

 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电子的流动方向是从电极1到电极2;电池的总反应为4NH3+3O2=2N2+6H2O.
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电子的流动方向是从电极1到电极2;电池的总反应为4NH3+3O2=2N2+6H2O.