题目内容
12.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.下列叙述不正确的是( )| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化成溶解度更小的沉淀 | |
| C. | 25℃时,在饱和AgCl、AgI、Ag2S溶液中所含c(Ag+)不同 | |
| D. | AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
分析 A.依据平衡移动原理回答即可;
B.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀;
C.根据溶度积计算Ag+的浓度;
D.依据同离子效应判断即可.
解答 解:A.沉淀转化的实质就是由难溶物质转化为更难溶的物质,故属于沉淀溶解平衡的移动,故A正确;
B.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,如向AgCl的白色悬浊液中加入KI溶液,可生成AgI沉淀,故B正确;
C.饱和AgCl、AgI、Ag2S溶液中Ag+的浓度分别为:$\sqrt{Ksp(AgCl)}$、$\sqrt{Ksp(AgI)}$、$\root{3}{Ksp(A{g}_{2}S)}$,由于三种物质的Ksp不同,所以Ag+的浓度不同,故C正确;
D.由于溶度积是常数,故氯离子浓度大,则银离子浓度小,所以AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不相同,故D错误.
故选D.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积常数的影响因素及溶度积常数的应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
17.“玉兔”在月球岩石中发现了铁橄榄石(主要成分是Fe2SiO4),其中铁的化合价是( )
| A. | +8 | B. | +3 | C. | +6 | D. | +2 |
14.在体积为VL的密闭容器中通入4mol CO和5mol O2,点燃充分反应后,容器内碳原子数和氧原子数之比为( )
| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
7.下列说法不正确的是( )
| A. | 锅炉水垢用Na2CO3溶液浸泡一段时间后,可用盐酸溶解 | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,固体颜色变深 | |
| C. | NaH2PO4溶液显酸性,Na2HPO4溶液显碱性,两种溶液中都有电离平衡和水解平衡 | |
| D. | 等物质的量浓度的(NH4)2CO3,(NH4)2SO4,(NH4)2Fe(SO4)2三种溶液,NH${\;}_{4}^{+}$浓度相等 |
4. 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
(1)获得硫酸铜:该小组同学利用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜,写出该反应的离子方程式:Cu+2H++H2O2═Cu2++2H2O.
(2)制备氧化铜:
粗CuSO4溶液(含有硫酸铁杂质)$\stackrel{步骤Ⅰ}{→}$纯CuSO4溶液$\stackrel{步骤Ⅱ}{→}$CuSO4•5H2O→…→CuO
已知:pH≥6.4时Cu(OH)2沉淀完全,而在pH=3~4时Fe(OH)3即能完全沉淀.
①步骤Ⅰ的目的是除去硫酸铁,可慢慢加入下列某些物质,搅拌,以控制溶液pH=3.5.加热煮沸一段时间,过滤,用稀硫酸酸化滤液至PH=1.下列物质有利于控制溶液PH=3.5的是AC.
A.Cu2(OH)2CO3粉末 B.Fe2O3粉末
C.Cu(OH)2固体 D.NaOH固体
②步骤Ⅱ的目的是得到CuSO4•5H2O固体,操作是蒸发浓缩、冷却结晶、过滤、水浴加热烘干.水浴加热的特点是受热更均匀,温度不会超过100℃.
(3)探究氧化铜的性质
探究氧化铜是否能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较.用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见表:
①上述实验中的“待测数据”指产生25mL气体所需时间.
②如何检查该装置的气密性:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气.
③为探究CuO在实验Ⅱ中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,b.CuO的化学性质有没有改变.
 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.(1)获得硫酸铜:该小组同学利用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜,写出该反应的离子方程式:Cu+2H++H2O2═Cu2++2H2O.
(2)制备氧化铜:
粗CuSO4溶液(含有硫酸铁杂质)$\stackrel{步骤Ⅰ}{→}$纯CuSO4溶液$\stackrel{步骤Ⅱ}{→}$CuSO4•5H2O→…→CuO
已知:pH≥6.4时Cu(OH)2沉淀完全,而在pH=3~4时Fe(OH)3即能完全沉淀.
①步骤Ⅰ的目的是除去硫酸铁,可慢慢加入下列某些物质,搅拌,以控制溶液pH=3.5.加热煮沸一段时间,过滤,用稀硫酸酸化滤液至PH=1.下列物质有利于控制溶液PH=3.5的是AC.
A.Cu2(OH)2CO3粉末 B.Fe2O3粉末
C.Cu(OH)2固体 D.NaOH固体
②步骤Ⅱ的目的是得到CuSO4•5H2O固体,操作是蒸发浓缩、冷却结晶、过滤、水浴加热烘干.水浴加热的特点是受热更均匀,温度不会超过100℃.
(3)探究氧化铜的性质
探究氧化铜是否能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较.用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| KClO3质量 | 1.2g | 1.2g | 1.2g |
| 其他物质质量 | 无其他物质 | CuO 0.5g | MnO2 0.5g |
| 待测数据 |
②如何检查该装置的气密性:上下移动量气管,使量气管液出现高度差,一段时间后量气管中的液面差不变,则装置不漏气.
③为探究CuO在实验Ⅱ中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,b.CuO的化学性质有没有改变.
2.下列原子中,第一电离能最大的是( )
| A. | He | B. | C | C. | Al | D. | Si |

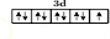 ;
;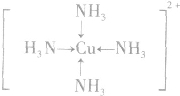 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;