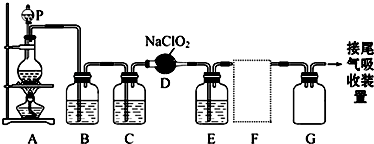
题目内容
1.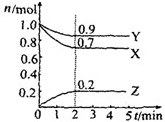 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:(1)该反应的化学方程式为:3X+Y?2Z
(2)反应开始至2min,用Z表示的平均反应速率为0.05mol/(L•min)
(3)下列叙述能说明上述反应达到化学平衡状态的是AB(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化.
分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算反应速率;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min末,Z的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)A、反应前后气体物质的量不同,所以气体物质的量不变,能说明反应达到平衡状态,故A正确;
B、反应前后气体物质的量不同,所以混合气体的压强不变,能说明反应达到平衡状态,故B正确;
C.单位时间内每消耗3mol X,同时生成2mol Z,都是正反应,无论是否平衡,其速率之比等于化学计量数之比,不能说明反应达到平衡状态,故C错误;
D.据质量守恒定律,气体质量始终不变,故D错误;
故选AB.
点评 本题考查化学平衡的变化图象,化学平衡状态的判断,题目难度不大,注意化学方程式的确定方法以及反应速率计算,把握好相关概念和公式的理解及运用.

| A. | 标况下,11.2L的SO3含有1.5NA个氧原子 | |
| B. | NA个CO2的质量为44g•mol-1 | |
| C. | 0.5mol•L-1CuCl2溶液中含Cl-数为NA | |
| D. | 1L1 mol•L-1 Na2CO3溶液中所含阴离子数目一定大于NA |
| A. | C1 | B. | C | C. | P | D. | Na |
| A. | 铝 | B. | 钛 | C. | 镁 | D. | 铁 |
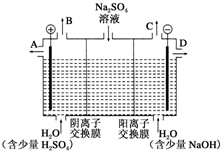 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.