题目内容
12.标准状况下,4.48L HCl气体溶于一定量的水配成200.00mL溶液,请根据题目所给出的数据计算(写出计算过程):(1)该溶液中HCl的物质的量浓度;
(2)取出20.00mL该溶液,往该溶液中加入铁片,则消耗多少克金属铁?
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出氯化氢的物质的量,然后根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度;
(2)取出溶液浓度不变,根据n=cV计算出含有HCl的物质的量,然后利用电子守恒计算出消耗铁定物质的量,最后利用m=nM计算出消耗铁的质量.
解答 解:(1)标准状况下,4.48L HCl气体的物质的量为:n(HCl)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
则该溶液中HCl的物质的量浓度为:c(HCl)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:该溶液中HCl的物质的量浓度为1.0mol/L;
(2)取出的20.00mL溶液浓度为1mol/L,取出溶液中含有HCl的物质的量为:1mol/L×0.02L=0.02mol,
根据电子守恒,消耗铁的物质的量为:n(Fe)=$\frac{0.02mol×1}{2}$=0.01mol,
所以消耗铁的质量为:m(Fe)=56g/mol×0.01mol=0.56g,
答:取出20.00mL该溶液,往该溶液中加入铁片,则消耗0.56g金属铁.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握电子守恒在氧化还原反应计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.某元素原子的第三电子层上只有2个电子,该元素在周期表中的位置是( )
| A. | 第二周期ⅠA族 | B. | 第三周期ⅠA族 | C. | 第二周期ⅦA族 | D. | 第三周期ⅡA族 |
20.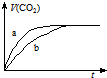 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
4.有关煤的叙述不正确的是( )
| A. | 煤是由有机物和无机物组成的复杂混合物 | |
| B. | 煤的干馏是工业上获得芳香烃的一种重要来源 | |
| C. | 煤在空气中加强热的过程叫做煤的干馏 | |
| D. | 煤焦油中含有苯和甲苯,可以用分馏的方法把它们分离出来 |
2.钠投入滴有酚酞的水中,不能证明钠具有下列哪些性质?( )
| A. | 钠的密度比水小 | B. | 钠的熔点低 | ||
| C. | 钠与水反应放出气体 | D. | 钠与水反应有酸生成 |
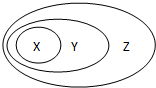 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )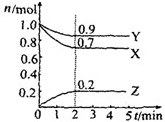 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析: