题目内容
9.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L.其工业提取法有:空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴,该方法涉及的反应有:①Cl2+2Br-=Br2+2Cl-(写出化学方程式)
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③BrO3-+5Br-+6H+=3Br2+3H2O.
其中中的氧化剂是Br2,还原剂是Br2.
空气吹出SO2吸收法.该方法基本同(1),只是吹出的溴用SO2来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴,写出溴与SO2反应的化学方程式:Br2+SO2+2H2O=2HBr+H2SO4.
溶剂萃取法.该法是利用单质溴在水中和萃取剂中溶解度的不同的原理不同来进行的.实验室中萃取用到的实验仪器名称是:分液漏斗、烧杯.下列可以用于海水中溴的萃取的试剂是四氯化碳.(选“乙醇、四氯化碳、硝酸”中的一项)
分析 (1)氯气有强氧化性,能氧化溴离子生成溴单质,还原剂失电子化合价升高而发生氧化反应;
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应;
(3)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应.
解答 解:(1)氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子,离子反应方程式为:Cl2+2Br-=Br2+2Cl-;Br2+3CO32-=BrO3-+5Br-+3CO2↑中Br2的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2;
故答案为:Cl2+2Br-=Br2+2Cl-;Br2;Br2;
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
(3)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,根据萃取剂的选取标准知,乙醇、硝酸都和水互溶,所以不能作萃取剂,能作萃取剂的是四氯化碳,
故答案为:分液漏斗;烧杯;四氯化碳.
点评 本题考查了氧化还原反应、萃取等知识点,根据元素的化合价变化、萃取剂的选取标准来分析解答即可,难度不大.

练习册系列答案
相关题目
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
20.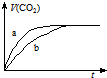 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
4.有关煤的叙述不正确的是( )
| A. | 煤是由有机物和无机物组成的复杂混合物 | |
| B. | 煤的干馏是工业上获得芳香烃的一种重要来源 | |
| C. | 煤在空气中加强热的过程叫做煤的干馏 | |
| D. | 煤焦油中含有苯和甲苯,可以用分馏的方法把它们分离出来 |
14.根据下列两个反应判断:2Cu+O2=2CuO,2Cu+S=Cu2S,下列叙述中错误的是( )
| A. | 硫和氧气反应中作氧化剂 | B. | 氧气的氧化性比硫强 | ||
| C. | 硫的氧化性比氧气强 | D. | 铜是一种具有可变化合价的元素 |
18.下列物质属于非电解质的是( )
| A. | Cu | B. | N2 | C. | KNO3 | D. | C2H5OH |
19.V LFe2(SO4)3溶液中含a mol SO42-,取此溶液$\frac{V}{2}$L用水稀释成2V L,则稀释后溶液的c(Fe3+)为 ( )
| A. | $\frac{2a}{3V}$mol/L | B. | $\frac{a}{3V}$mol/L | C. | $\frac{a}{6V}$mol/L | D. | $\frac{a}{4V}$mol/L |
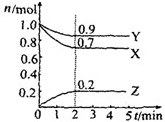 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析: