题目内容
16.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl如图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2).
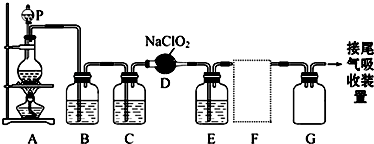
(1)仪器P的名称是分液漏斗.
(2)写出装置A中烧瓶内发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)B装置中所盛试剂是饱和食盐水,作用是除去氯气中的氯化氢气体
(4)F处应选用的收集装置是②(填序号),其中与E装置导管相连的导管口是d(填接口字母).

(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是D
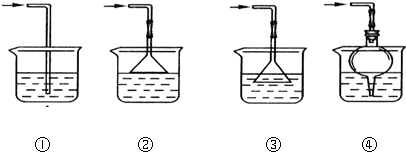
A.①②B.②③C.③④D.②④
分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,被氧化的HCl的物质的量.
解答 解:(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗,
故答案为:分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水,
故答案为:饱和食盐水;除去氯气中的氯化氢气体;
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞;
故答案为:②;d;
(5)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,②④符合;
故答案为:D.
点评 本题考查气体的制备、除杂、收集等实验操作,题目难度不大,学习中注意把握化学实验基本操作,做该类题目时把握实验目的和实验原理是解答题目的关键.

| A. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol | |
| C. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol |
| A. | 煤是由有机物和无机物组成的复杂混合物 | |
| B. | 煤的干馏是工业上获得芳香烃的一种重要来源 | |
| C. | 煤在空气中加强热的过程叫做煤的干馏 | |
| D. | 煤焦油中含有苯和甲苯,可以用分馏的方法把它们分离出来 |
| A. | 金属钠存放于煤油中 | |
| B. | 硝酸贮存在避光低温处 | |
| C. | 在盛溴的试剂瓶中加一定量的水液封,防止溴的挥发 | |
| D. | 单质碘贮存在棕色的细口瓶中 |
| A. | 1:3 | B. | 1:1 | C. | 9:1 | D. | 3:1 |
| A. | 可用毛巾蘸取肥皂水捂嘴防毒 | B. | 在氯气泄露的地区人应站在高处 | ||
| C. | 向氯气喷洒稀氨水可以消毒 | D. | 将泄露的氯气在空气中点燃除去 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于较长时间没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)写出实验③的化学反应方程式2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.

分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )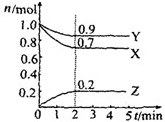 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析: