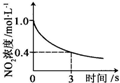
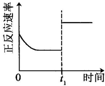
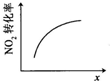
题目内容
下表为元素周期表的一部分,请参照元素①~⑦在表中的位置,用化学用语回答下列问题.
(1)元素①的原子结构示意图为 .
(2)元素⑦的高价氧化物电子式为 ;③和⑥可形成化合物,用电子式表示形成其过程 .
(3)元素②、③形成离子的半径 > .
(4)元素⑤、⑥形成的气态氢化物稳定性 > ;元素③、④形成的最高价氧化物水化物的碱性 > .
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应的离子方程式为: .

(1)元素①的原子结构示意图为
(2)元素⑦的高价氧化物电子式为
(3)元素②、③形成离子的半径
(4)元素⑤、⑥形成的气态氢化物稳定性
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应的离子方程式为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知①为N,②为F,③为Na,④为Al,⑤为S,⑥为Cl,⑦为C,
(1)①为N,原子核外有2个电子层,最外层电子数为5,以此书写原子结构示意图;
(2)元素⑦的高价氧化物为二氧化碳;③和⑥可形成NaCl;
(3)②、③形成离子具有相同的核外电子排布,核电荷数越大,离子半径越小;
(4)同周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,非金属性越强,对应的最高价氧化物的酸性越强;
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应为氧化铝与氢氧化钠的反应.
(1)①为N,原子核外有2个电子层,最外层电子数为5,以此书写原子结构示意图;
(2)元素⑦的高价氧化物为二氧化碳;③和⑥可形成NaCl;
(3)②、③形成离子具有相同的核外电子排布,核电荷数越大,离子半径越小;
(4)同周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,非金属性越强,对应的最高价氧化物的酸性越强;
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应为氧化铝与氢氧化钠的反应.
解答:
解:由元素在周期表中的位置可知①为N,②为F,③为Na,④为Al,⑤为S,⑥为Cl,⑦为C,
(1)①为N,原子核外有2个电子层,最外层电子数为5,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素⑦的高价氧化物为二氧化碳,电子式为 ,③和⑥可形成NaCl,用电子式表示形成其过程为
,③和⑥可形成NaCl,用电子式表示形成其过程为 ,
,
故答案为: ;
; ;
;
(3)②、③形成离子具有相同的核外电子排布,核电荷数越大,离子半径越小,应为F->Na+,故答案为:F-;Na+;
(4)同周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,非金属性越强,对应的最高价氧化物的酸性越强,应为HCl>H2S;NaOH>Al(OH)3,
故答案为:HCl;H2S;NaOH;Al(OH)3;
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应为氧化铝与氢氧化钠的反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)①为N,原子核外有2个电子层,最外层电子数为5,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)元素⑦的高价氧化物为二氧化碳,电子式为
 ,③和⑥可形成NaCl,用电子式表示形成其过程为
,③和⑥可形成NaCl,用电子式表示形成其过程为 ,
,故答案为:
 ;
; ;
;(3)②、③形成离子具有相同的核外电子排布,核电荷数越大,离子半径越小,应为F->Na+,故答案为:F-;Na+;
(4)同周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,非金属性越强,对应的最高价氧化物的酸性越强,应为HCl>H2S;NaOH>Al(OH)3,
故答案为:HCl;H2S;NaOH;Al(OH)3;
(5)元素④的最高价氧化物与元素③最高价氧化物的水化物稀溶液反应为氧化铝与氢氧化钠的反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式的书写.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |
下列电子式书写错误的是( )
A、 |
B、 |
C、 |
D、 |
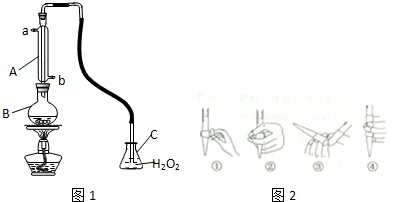
 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表: