题目内容
12.下列应用涉及氧化还原反应的是( )| A. | 纯碱用于制造玻璃 | B. | 工业上利用合成氨实现人工固氮 | ||
| C. | 打磨磁石制指南针 | D. | 医疗上用小苏打治疗胃酸过多 |
分析 氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,应存在元素化合价的变化,结合对应物质的性质解答该题.
解答 解:A.纯碱用于制造玻璃,没有元素的化合价变化,不发生氧化还原反应,故A错误;
B.人工固氮,氮气生成氨气、氮氧化物等物质,N元素化合价发生变化,属于氧化还原反应,故B正确;
C.打磨磁石制指南针,属于物理变化,故C错误;
D.医药上用小苏打治疗胃酸过多,没有元素的化合价变化,不发生氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
3.实验室保存下列试剂的方法不正确的是( )
| A. | 钠保存在煤油中 | |
| B. | 用棕色试剂瓶盛放新制的氯水 | |
| C. | 冷的浓硝酸不能用钢瓶保存 | |
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
20.下列有关说法正确的是( )
| A. | 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种 | |
| B. | 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上 | |
| C. | 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应 | |
| D. | 乙烯和苯都能使溴水褪色,且褪色的原理相同 |
17.下列叙述I和Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点髙硬度大 | 可用于制作半导体材料 |
| B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| C | NH4HCO3受热易分解 | 可用作氮肥 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
4.CuO和Fe2O3组成的混合物m g,向其中加入100mL0.5mo1•L-1的H2SO4液恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体的质量为( )
| A. | (2m-1.6)g | B. | (m-0.8)g | C. | (m-1.6)g | D. | (2m-0.8)g |
1.下列不能使有色布条或品红褪色的物质是( )
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 二氧化硫 | D. | 氯化钙溶液 |
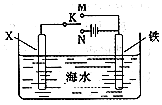 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.