题目内容
2. 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.①以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,用总反应的离子
方程式表示产生这些现象的原因:3HCO3-+Al3+=3CO2↑+Al(OH)3↓.
②在铁制品上镀铜时,一般装置(阴极、阳极、电镀液分别)是铜作阳极,铁制品作阴极,铜盐为电镀液.
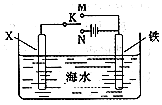
③利用如图装置,可以模拟铁的电化学防护.
若X为碳棒,为减缓铁的腐蚀,开关K应该置于N处.若X为锌,开光K置于M处,这两种方法分别称为外加电流的阴极保护法、牺牲阳极的阴极保护法.
分析 ①铝为阳极失电子发生氧化反应,表面形成氧化膜生成氧化铝;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+和HCO3-发生了互促水解反应生成氢氧化铝沉淀与二氧化碳;
②电镀时,镀层金属作阳极,待镀金属作阴极,含镀层金属盐作电镀液;
③若X为碳棒,为减缓铁的腐蚀,开关K应该置于N处形成电解池,Fe为阴极被保护;
若X为锌,开光K置于M处形成原电池,锌比Fe活泼,Fe为正极被保护.
解答 解:①铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+和HCO3-发生了互促水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
②铁制品上镀铜时,铜作阳极,铁制品作阴极,铜盐为电镀液,故答案为:铜作阳极,铁制品作阴极,铜盐为电镀液;
③若X为碳棒,为减缓铁的腐蚀,开关K应该置于N处形成电解池,Fe为阴极被保护,该方法为外加电流的阴极保护法;
若X为锌,开光K置于M处形成原电池,锌比Fe活泼,Fe为正极被保护,该方法为牺牲阳极的阴极保护法;
故答案为:外加电流的阴极保护法;牺牲阳极的阴极保护法.
点评 本题考查了电解原理的应用,原电池原理的分析判断,主要是电解原理的分析判断,电极反应书写等,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列各组分子中,都属于含有极性键的非极性分子的是( )
| A. | CO2、H2S | B. | H2O2、C3H6 | C. | C2H4、CH4 | D. | NH3、HCl |
7.下列关于电解质溶液的叙述不正确的是( )
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
12.下列应用涉及氧化还原反应的是( )
| A. | 纯碱用于制造玻璃 | B. | 工业上利用合成氨实现人工固氮 | ||
| C. | 打磨磁石制指南针 | D. | 医疗上用小苏打治疗胃酸过多 |

 .
.
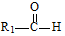 +
+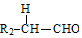 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$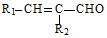 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)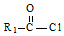 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$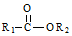 +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基) .
. .
.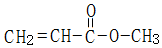
 .
.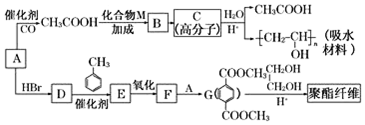
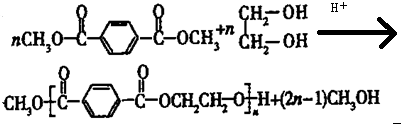 .
. 合成
合成  的流程图(注明反应条件)
的流程图(注明反应条件) .
.