题目内容
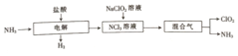
4.CuO和Fe2O3组成的混合物m g,向其中加入100mL0.5mo1•L-1的H2SO4液恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体的质量为( )| A. | (2m-1.6)g | B. | (m-0.8)g | C. | (m-1.6)g | D. | (2m-0.8)g |
分析 CuO和Fe2O3与硫酸反应生成硫酸盐和水,由硫酸的物质的量可知m g金属氧化物中O元素的物质的量,用CO还原混合物得到金属的质量=金属氧化物的质量减去氧元素的质量,以此来解答.
解答 解:加入100mL0.5mo1•L-1的H2SO4液恰好完全反应,n(H2SO4)=0.1L×0.5mol/L=0.05mol,
CuO和Fe2O3与硫酸反应生成硫酸盐和水,可知金属氧化物中n(O)=n(H2SO4)=0.05mol,含氧元素的质量为0.05mol×16g/mol=0.8g,
若等量的混合物用足量CO还原,充分反应后剩余固体为金属单质,其质量为m g-0.8g=(m-0.8)g,
则将2m g该混合物用足量CO还原,充分反应后剩余固体的质量为(2m-1.6)g,
故选A.
点评 本题考查混合物的计算,为高频考点,把握氧化物与酸反应的特点、原子守恒为解答的关键,侧重分析与计算能力的考查,注意混合物质量的变化,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列应用涉及氧化还原反应的是( )
| A. | 纯碱用于制造玻璃 | B. | 工业上利用合成氨实现人工固氮 | ||
| C. | 打磨磁石制指南针 | D. | 医疗上用小苏打治疗胃酸过多 |
19.下列离子方程式正确的是( )
| A. | 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| B. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
9.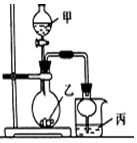 利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
 利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
| B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
13.已知NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 2 g H2的分子数为NA | |
| B. | 标准状况下,22.4 L H2O含有NA个水分子 | |
| C. | 7.8 g过氧化钠与足量水反应转移的电子数为0.2NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
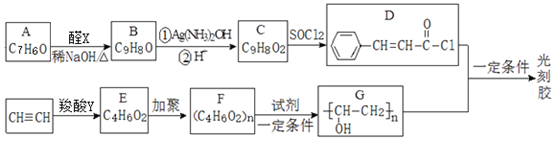
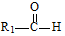 +
+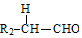 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$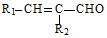 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)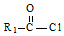 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$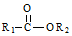 +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基) .
. .
.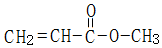
 .
.