题目内容
在20mL由HNO3和H2SO4组成的混合溶液中,逐滴加入4mol/L Ba(OH)2溶液,结果如图所示,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
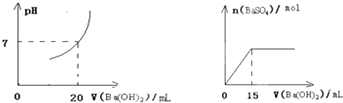
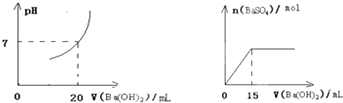
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:由图可知,加入15mLBa(OH)2溶液时,硫酸钡沉淀达最大值,故根据H2SO4+Ba(OH)2═BaSO4↓+H2O计算硫酸的物质的量;
由图可知,PH=7时消耗20mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),进而计算HNO3电离产生的氢离子物质的量,再根据c=
计算HNO3和H2SO4的物质的量浓度.
由图可知,PH=7时消耗20mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),进而计算HNO3电离产生的氢离子物质的量,再根据c=
| n |
| V |
解答:
解:由图可知,加入15mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.015L×4mol/L
故x=0.015L×4mol/L=0.06mol,
硫酸的物质的量浓度为
=3mol/L,
由图可知,PH=7时,消耗20mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=2×0.02L×4mol/L=0.16mol,故n(HNO3)=0.16mol-0.06mol×2=0.04mol,
故原溶液中HNO3的物质的量浓度=
=2mol/L,
答:原混合液中硫酸的物质的量浓度为3mol/L,硝酸的物质的量浓度为2mol/L.
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.015L×4mol/L
故x=0.015L×4mol/L=0.06mol,
硫酸的物质的量浓度为
| 0.06mol |
| 0.02L |
由图可知,PH=7时,消耗20mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=2×0.02L×4mol/L=0.16mol,故n(HNO3)=0.16mol-0.06mol×2=0.04mol,
故原溶液中HNO3的物质的量浓度=
| 0.04mol |
| 0.02L |
答:原混合液中硫酸的物质的量浓度为3mol/L,硝酸的物质的量浓度为2mol/L.
点评:本题考查混合物计算、化学方程式的有关计算,明确图象中对应的化学反应是解答本题的关键,注意利用反应方程式及离子方程式进行计算,难度中等.

练习册系列答案
相关题目
在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |



 分子式
分子式 联苯:
联苯: 它们的分子式分别为
它们的分子式分别为