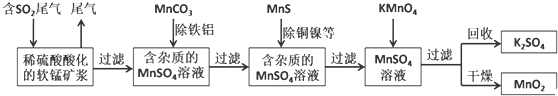
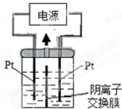
题目内容
下列离子或分子在溶液中能大量共存,加入足量Na2O2后溶液中仍能大量共存的是( )
| A、K+、Cl-、Na+、SiO32- | ||
B、Ba2+、NO
| ||
| C、K+、Na+、I-、SO42- | ||
D、Na+、Cu2+、NH3.H2O、SO
|
考点:离子共存问题
专题:
分析:根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,则离子大量共存,结合加入足量Na2O2后不能发生氧化还原反应、复分解反应来解答.
解答:
解:A.该组离子之间不反应,可大量共存,且加入足量Na2O2后溶液中离子之间不反应,仍能大量共存,故A选;
B.加入足量Na2O2后与Al3+反应,不能共存,故B不选;
C.加入足量Na2O2后与I-发生氧化还原反应,不能共存,故C不选;
D.Cu2+、NH3.H2O结合生成沉淀,不能共存,故D不选;
故选A.
B.加入足量Na2O2后与Al3+反应,不能共存,故B不选;
C.加入足量Na2O2后与I-发生氧化还原反应,不能共存,故C不选;
D.Cu2+、NH3.H2O结合生成沉淀,不能共存,故D不选;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
现有1.0mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是( )
| A、c(Na+)=c(H2SO3)+c(HSO3-)+c (H+) |
| B、c(SO32-)+c(OH-)=c(H+)+c(H2SO3) |
| C、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
化学与生产、生活密切相关.下列叙述错误的是( )
| A、光导纤维和陶瓷都是硅酸盐产品 |
| B、晶体硅可用于制造芯片 |
| C、钢铁厂用热还原法冶炼铁 |
| D、焙制糕点的发酵粉主要成分之一是碳酸氢钠 |
拟晶Al65Cu23Fe12具有合金的某些优良物理性能,将相同质量的此拟晶分别与足量的盐酸、烧碱和稀硝酸反应,产生气体物质的量关系为( )
| A、n(盐酸)<n(稀硝酸)<n(烧碱) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(稀硝酸)<n(烧碱)<n(盐酸) |
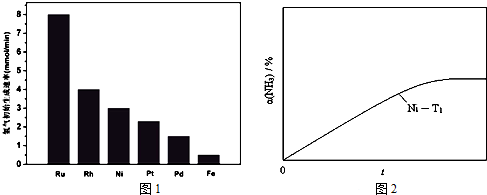



 .T的核磁共振氢谱只有两组峰,则Q的结构简式为
.T的核磁共振氢谱只有两组峰,则Q的结构简式为 和
和 ,M的结构简式为
,M的结构简式为