题目内容
现有1.0mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是( )
| A、c(Na+)=c(H2SO3)+c(HSO3-)+c (H+) |
| B、c(SO32-)+c(OH-)=c(H+)+c(H2SO3) |
| C、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:n(NaOH)=1.0mol/L×0.2L=0.2mol,n(SO2)=
=0.2mol,二者的物质的量之比为1:1,所以二者恰好反应生成NaHSO3,溶液中存在电荷守恒、物料守恒,据此分析解答.
| 4.48L |
| 22.4L/mol |
解答:
解:n(NaOH)=1.0mol/L×0.2L=0.2mol,n(SO2)=
=0.2mol,二者的物质的量之比为1:1,所以二者恰好反应生成NaHSO3,
A.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),溶液中c( H+)>c(SO32-),所以c(Na+)<c(H2SO3)+c(HSO3-)+c ( H+),故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),存在物料守恒c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),所以得c(SO32-)+c( OH-)=c(H+)+c(H2SO3),故B正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),故C错误;
D.溶液中HSO3-电离程度大于水解程度,则c(H2SO3)<c(SO32-),溶液呈酸性,则c( OH-)<c(H+),故D错误;
故选B.
| 4.48L |
| 22.4L/mol |
A.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),溶液中c( H+)>c(SO32-),所以c(Na+)<c(H2SO3)+c(HSO3-)+c ( H+),故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),存在物料守恒c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-),所以得c(SO32-)+c( OH-)=c(H+)+c(H2SO3),故B正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c( OH-),故C错误;
D.溶液中HSO3-电离程度大于水解程度,则c(H2SO3)<c(SO32-),溶液呈酸性,则c( OH-)<c(H+),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液酸碱性再结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
下列离子或分子在溶液中能大量共存,加入足量Na2O2后溶液中仍能大量共存的是( )
| A、K+、Cl-、Na+、SiO32- | ||
B、Ba2+、NO
| ||
| C、K+、Na+、I-、SO42- | ||
D、Na+、Cu2+、NH3.H2O、SO
|
下列有关溶液组成的描述合理的是( )
| A、无色溶液中可能大量存在Cu2+、NH4+、Cl-、S2- |
| B、中性溶液中可能大量存在Fe3+、K+、Cl-、CO32- |
| C、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| D、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
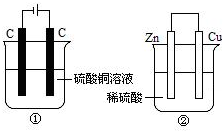 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |


 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是