题目内容
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,8g CH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数可能为1.5NA个 |
分析 A、求出甲烷的物质的量,然后根据甲烷中含10个电子来分析;
B、求出氦气的物质的量,然后根据氦气为单原子分子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、8g甲烷的物质的量为0.5mol,而甲烷中含10个电子,故0.5mol甲烷中含5NA个电子,故A正确;
B、标况下22.4L氦气的物质的量为1mol,而氦气为单原子分子,故含NA个氦原子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L混合气体的物质的量小于1mol,则含有的氧原子的个数小于2NA个,故C错误;
D、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含氮原子为NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、Br2 |
| ③ | MnO2… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第③组反应中生成1mol Cl2,转移电子4mol | |
| C. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为3:2 |
14.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  图除去CO2中的HCl | |
| B. |  图装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  图所示装置制取并收集干燥纯净的NH3 | |
| D. | 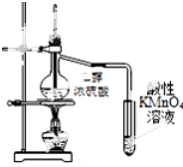 图证明CH3CH2OH发生消去反应生成了乙烯 |
11.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
请回答:
(1)根据①组实验情况,分析混合溶液的pH=9的原因是H2O+A-?HA+OH-.(用反应的离子方程式表示),在该溶液中下列关系式正确的是(填序号字母)BD.
A.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+) D.c(Na+)+c(H+)=c(OH-)+c(A-)
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是H2O+A-?HA+OH-.(用反应的离子方程式表示),在该溶液中下列关系式正确的是(填序号字母)BD.
A.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-)+c(Na+) D.c(Na+)+c(H+)=c(OH-)+c(A-)
(2)②组情况表明,c>0.2mol•L-1(选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)=c(Na+)(选填“>”、“<”或“=”)
(3)从③组实验结果分析,说明溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
18.自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石.已知该尖晶石中混有Fe2O3,取一定量样品3.2g,恰好与一定浓度100mL盐酸反应,盐酸浓度可能是( )
| A. | 1.1 mol•l-1 | B. | 1.5mol•L-1 | C. | 2.4 mol•L-1 | D. | 无法确定 |
8.分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )
| A. | HNO3、NaCl、K2SO4 | B. | KCl、NaOH、CuSO4 | ||
| C. | BaCl2、NaOH、H2SO4 | D. | FeCl3、Na2SO4、KCl |
15.下列反应可用离子方程式“H++OH-=H2O”表示的是( )
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
12.下列做法不会对人体健康造成危害的是( )
| A. | 加三聚氰胺提高牛奶的含氮量 | |
| B. | 用苏丹红(色素)作食品着色剂 | |
| C. | 加小苏打(NaHCO3)作馒头的膨松剂 | |
| D. | 用含有甲醇(CH3OH)的工业酒精兑制饮用白酒 |
8.从理论上讲,一切自发的氧化还原反应均可设计成原电池,下列不正确的是( )
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |