题目内容
18.自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石.已知该尖晶石中混有Fe2O3,取一定量样品3.2g,恰好与一定浓度100mL盐酸反应,盐酸浓度可能是( )| A. | 1.1 mol•l-1 | B. | 1.5mol•L-1 | C. | 2.4 mol•L-1 | D. | 无法确定 |
分析 假设晶体中成分全部是MgAl2O4,根据关系式计算盐酸的物质的量浓度;假设晶体中成分全部是Fe2O3,根据关系式计算盐酸的物质的量浓度,实际上晶体中含有MgAl2O4、Fe2O3,则盐酸的浓度介于二者之间,据此分析解答.
解答 解:假设晶体中成分全部是MgAl2O4,与盐酸反应的关系式为MgAl2O4---8HCl,n(MgAl2O4)=$\frac{3.2g}{142g/mol}$=0.0225mol,则c(HCl)=$\frac{0.0225mol×8}{0.1L}$=1.8mol/L;
假设晶体中成分全部是Fe2O3,与盐酸反应关系式为Fe2O3---6HCl,n(Fe2O3)=$\frac{3.2g}{160g/mol}$=0.02mol,则c(HCl)=$\frac{0.02mol×6}{0.1L}$=1.2mol/L,实际上晶体中含有MgAl2O4、Fe2O3,所以实际上盐酸的浓度在这两种浓度之间,
故选B.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量的关系式是解本题关键,采用极值法分析解答,注意化学解题方法的灵活运用,题目难度不大.

练习册系列答案
相关题目
8.某可逆反应aA+bB?cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q.保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
| A. | 写成2aA+2bB?2cC,Q值、K值均扩大了一倍 | |
| B. | 写成2aA+2bB?2cC,Q值扩大了一倍,K值保持不变 | |
| C. | 写成cC?aA+bB,Q值、K值变为原来的相反数 | |
| D. | 写成cC?aA+bB,Q值变为原来的相反数,K值变为倒数 |
9.某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
| A. | C5H12 | B. | C6H14 | C. | C7H16 | D. | C8H18 |
13.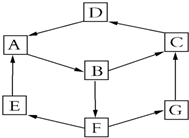 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
已知①A、B、C、D、G含有同种元素.
②
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G.
依据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色写出对应的离子方程式FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)写出反应A→B的化学方程式:2Fe+3Cl2=2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;G与次氯酸反应的离子方程式为2Fe2++HClO+H+=2Fe3++Cl-+H2O.
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:已知①A、B、C、D、G含有同种元素.
②
| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
依据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色写出对应的离子方程式FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)写出反应A→B的化学方程式:2Fe+3Cl2=2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;G与次氯酸反应的离子方程式为2Fe2++HClO+H+=2Fe3++Cl-+H2O.
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,8g CH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数可能为1.5NA个 |
10.下列说法正确的是( )
| A. | 甲基戊烷也称为新戊烷 | B. | 由苯制取溴苯的反应属于加成反应 | ||
| C. | C2H4Br2有2种同分异构体 | D. | 乙醇和乙酸均为非电解质 |
7.将amolH2和Cl2的混合气体点燃,充分反应后用足量的NaOH溶液吸收,消耗了bmolNaOH.
(1)填表
(2)以n(Cl2)为横坐标,n(NaCl)为纵坐标,作出生成的NaCl与消耗的Cl2的关系图.
(1)填表
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |