题目内容
17.下列关于物质的浓度的说法正确的是( )| A. | 将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |
分析 A.物质的量浓度中体积为溶液的体积;
B.氢氧化钠为离子化合物;
C.计算混合溶液中氯离子物质的量和溶液体积,依据C=$\frac{n}{V}$计算;
D.稀释中溶质的质量不变,溶液质量变为原来2倍,根据质量分数的定义判断.
解答 解:A.将5.85 g NaCl固体溶于1 L水中,得到溶液体积大于1L,配成NaCl 溶液浓度小于0.1mol/L,故A错误;
B.氢氧化钠为离子化合物,溶于水完全电离,所以溶液中不含有氢氧化钠分子,故B错误;
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的n(Cl-)=3mol/L×2×0.2L+3mol/L×0.1L=1.5mol,溶液中的c(Cl-)=$\frac{1.5mol}{0.3L}$=5mol/L,故C错误;
D.100g20%的NaCl溶液中氯化钠质量为20g,稀释中溶质的质量不变,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故D正确;
故选D.
点评 本题考查物质的量浓度与质量分数浓度计算,明确物质的量浓度定义及溶液稀释过程溶质的质量、物质的量不变是解题关键,题目难度中等,注意溶液混合体积的计算.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
13.下列物质的制备与工业生产实际相符合的是( )
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
8.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
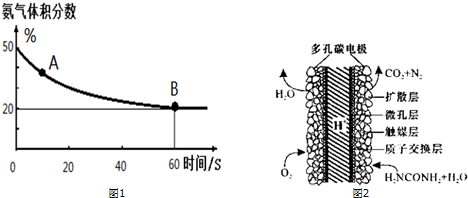
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);

氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
12.下列说法正确的是( )

| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
9.下列各项表述中正确的是( )
| A. | 氢氧燃料电池就是将氢气在氧气中燃烧,从而获得电流 | |
| B. | 46g的乙醇和28g的乙烯完全燃烧时消耗的O2均为为67.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数一定也为7 | |
| D. | Cl-的结构示意图为 |

