题目内容
12.下列说法正确的是( )
| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
分析 A.放气的方法:将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
B.应该在坩埚中加热胆矾晶体使其失去结晶水;
C.碘单质易溶于四氯化碳,无法通过分液操作分离;
D.海水中水的沸点较低、盐的沸点较高,可通过蒸馏分离.
解答 解:A.萃取操作时,振荡的过程中需要进行放气,放气的方法:将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,故A错误;
B.图3为蒸发操作,加热胆矾晶体使其失去结晶水需要在坩埚中进行,故B错误;
C.分离CCl4和I2的混合液不分层,无法通过分液分离,故C错误;
D.海水中水的沸点较低,则利用图中蒸馏实验装置可制取少量淡水,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及蒸馏、蒸发、分液等操作,把握物质的性质、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
8.教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
(1)用电离方程式表示草酸溶液显酸性的原因H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.
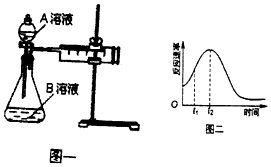
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.

20.采自地质深层的矿泉水常溶有岩石所含放射性物质在衰变过程中释放的氡,下列关于该类矿泉水说法正确的是( )
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
7.已知1g的甲烷燃烧生成二氧化碳和液态水放出的热量为55.625kJ•g-1.下列热化学方程式中不正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | $\frac{1}{2}$CO2(g)+H2O(l)═$\frac{1}{2}$CH4(g)+O2(g)△H=+445 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.625 kJ/mol |
17.下列关于物质的浓度的说法正确的是( )
| A. | 将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |