题目内容
4.写出下列电解质在熔融状态或水溶液中的电离方程式H2SO4:H2SO4=2H++SO42-
FeCl3:FeCl3=Fe3++3Cl-.
分析 硫酸属于强酸为强电解质,水溶液中完全电离出氢离子和硫酸根离子,氯化铁为溶于水的盐,水溶液中完全电离出铁离子和3个氯离子,据此书写电离方程式.
解答 解:H2SO4是强电解质,水溶液中完全电离,电离方程式为:H2SO4=2H++SO42-,
FeCl3:是盐为强电解质,水溶液中完全电离,电离方程式为:FeCl3=Fe3++3Cl-,
故答案为:H2SO4=2H++SO42-;FeCl3=Fe3++3Cl-.
点评 本题考查了电离方程式的书写,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握弱酸、弱碱的电离方程式的区别,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.已知:Ni+CuSO4→NiSO4+Cu;Cu+2AgNO3→Cu(NO3)2+2Ag,则下列判断正确的是( )
| A. | 还原性:Ni>Cu | B. | 氧化性:Cu2+>Ag+ | C. | 还原性:Ag>Cu | D. | 氧化性:Ni2+>Ag+ |
15.下列关于配位化合物的叙述中,不正确的是( )
| A. | 配位化合物中必定存在配位键 | |
| B. | 配位化合物中只有配位键 | |
| C. | 〔Fe(SCN)6〕3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键 | |
| D. | 许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如N3、H+等)都能形成配合物 |
12.含有 NaBr、NaI 的溶液中通入过量的 Cl2,然后将溶液蒸干,并灼烧固体,最后得到的 物质是( )
| A. | NaCl | B. | NaCl 和 NaBr | C. | NaCl 和 NaI | D. | NaCl 和 I2 |
19.由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
| 装置 | 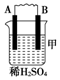 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
9.下列陈述I、II正确且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2有漂白作用 | Cl2能使湿润的有色布条褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | 浓氨汽化时要吸收大量的热 | 浓氨可用作制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
13.下列变化过程中,没有发生化学变化的是( )
| A. | 用食盐水生产氯气 | B. | 从海带中提取碘 | ||
| C. | 氨气加压制液氨 | D. | 用黏土和石灰石制水泥 |
9.下列关于某些离子的检验说法中正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有 CO32- | |
| B. | 某溶液与浓 NaOH 溶液共热,产生使湿润蓝色石蕊试纸变红气体,则原溶液中存在 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO 42- | |
| D. | 可用硝酸酸化的 AgNO3 溶液鉴别 Cl-、Br-、I- |
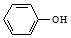 和
和 两种物质的试剂是a(填字母).
两种物质的试剂是a(填字母).