题目内容
15.下列关于配位化合物的叙述中,不正确的是( )| A. | 配位化合物中必定存在配位键 | |
| B. | 配位化合物中只有配位键 | |
| C. | 〔Fe(SCN)6〕3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键 | |
| D. | 许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如N3、H+等)都能形成配合物 |
分析 A.配合物中一定含有配位键;
B.配位化合物中不仅含有配位键;
C.中心原子提供空轨道,配体提供孤电子对;
D.根据配位键的形成条件解答,中心原子提供空轨道,配体提供孤电子对.
解答 解:A.配合物中一定含有配位键,还含有共价键,故A正确;
B.配位化合物中不仅含有配位键,还含有共价键,可能含有离子键,如[Cu(H2O)4]SO4中,Cu2+提供空轨道,H2O中的O原子提供孤对电子,两者结合形成配位键,H2O中H-O共价键,[Cu(H2O)4]2+与SO42-形成离子键,故B错误;
C.在配合物离子[Fe(SCN)6]3-中,中心离子是Fe3+,提供提供空轨道接受孤对电子,SCN-中的硫原子提供孤电子对形成配位键,故C正确;
D.过渡元素原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,与过渡元素原子或离子形成配合物的分子或离子应具备的条件是具有孤对电子,过渡元素的离子(如Cu2+、Ag+等)提供提供空轨道接受孤对电子,主族元素的离子或分子(如N3、H+等)提供孤电子对,能形成配合物,故D正确;
故选B.
点评 本题考查了配合物的结构,明确配位键的形成条件是解答关键,题目难度中等.

练习册系列答案
相关题目
6.某澄清溶液可能由KI、NaNO3、CaCl2和Na2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验;(1)上述溶液中滴加AgNO3溶液有浅黄色沉淀产生;(2)将沉淀滤出加HNO3时,沉淀部分溶解,有气体放出;(3)向一份溶液中加淀粉溶液,再加适量氯水,溶液显蓝色.根据以上实验可判断( )
| A. | 一定有CaCl2和Na2CO3,一定没有KI,可能有NaNO3 | |
| B. | 一定有KI、Na2CO3,可能有NaNO3、CaCl2 | |
| C. | 一定有KI、Na2CO3,可能有NaNO3,一定没有CaCl2 | |
| D. | 只有Na2CO3,可能有NaNO3,一定没有KI、CaCl2 |
10.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  实验室制氨气 | ||
| C. |  排水集气法收集NO | D. |  除去Cl2中的HCl |
20.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△S<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气的反应速率和转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
7.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的 是( )
| A. |  点燃酒精灯 | B. |  称量固体 | C. |  液体加热 | D. |  量取9.0mL液体 |
 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
 .写出该反应的离子方程式Fe3S4+6H+=3H2S↑+3Fe2++S.
.写出该反应的离子方程式Fe3S4+6H+=3H2S↑+3Fe2++S.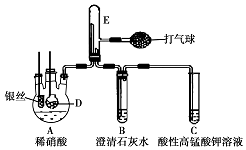 某化学实验小组利用如图装置证明银和稀硝酸反应产生NO,D是内置块状大理石的多孔玻璃笼.(加热装置和夹持装置均已略去.
某化学实验小组利用如图装置证明银和稀硝酸反应产生NO,D是内置块状大理石的多孔玻璃笼.(加热装置和夹持装置均已略去.