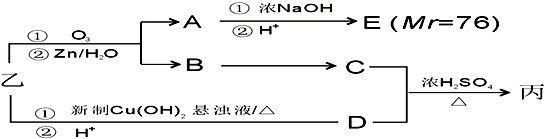
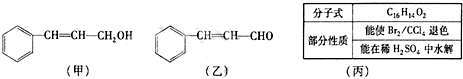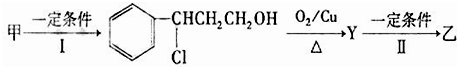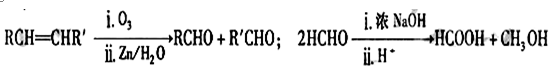��Ŀ����
̼���ƺ�̼��������һ���������¿��Ի���ת����
��1������̼�����ƹ��弴�ɵ�̼���ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2����̼������Һ��ͨ�������̼�����Եõ�̼�� ���ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ ��
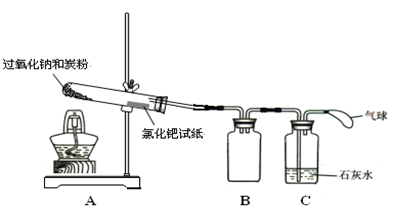
��3�������ʵ�鷽����ȥ̼���ƹ����л��е�����̼�����ƣ�
��4�������ʵ�鷽����ȥ̼��������Һ�л��е�����̼���ƣ�
��5����ּ���̼���ƺ�̼�����ƵĻ����95g����ȫ��Ӧ��õ�����5.6L����״��������������̼����ȥ������������
��6������ij̼���ƺ�̼�����ƵĻ������Ʒ����������ַ����ⶨ����̼���Ƶ�����������
��1������̼�����ƹ��弴�ɵ�̼���ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ
��2����̼������Һ��ͨ�������̼�����Եõ�̼�� ���ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ
��3�������ʵ�鷽����ȥ̼���ƹ����л��е�����̼�����ƣ�
��4�������ʵ�鷽����ȥ̼��������Һ�л��е�����̼���ƣ�
��5����ּ���̼���ƺ�̼�����ƵĻ����95g����ȫ��Ӧ��õ�����5.6L����״��������������̼����ȥ������������
��6������ij̼���ƺ�̼�����ƵĻ������Ʒ����������ַ����ⶨ����̼���Ƶ�����������
���㣺�Ƶ���Ҫ������
ר�⣺Ԫ�ؼ��仯����
��������1������̼�����ƹ��弴�ɵ�̼���ơ�ˮ�Ͷ�����̼��
��2��̼������Һͨ�������̼��������̼�����ƣ�
��3��̼�����Ƽ������ֽ⣬����ֱ�Ӽ��ȳ�ȥ����̼�����ƣ�
��4�����ݳ���������Ҫ���������������ټ�����Լ�ֻ�������ʷ�Ӧ��������ԭ���ʷ�Ӧ���ڷ�Ӧ���������µ����ʣ�̼��������Һ�е�̼���ƿ���ͨ�������̼ʹ��ת��Ϊ̼�����ƣ��ݴ˻ش�
��5�����ȷ�����Ӧ��2NaHCO3
Na2CO3+H2O+CO2��������n=
���������̼�����ʵ��������ݷ���ʽ����̼���������ʵ������ٸ���m=nM����̼�����Ƶ���������������ԭ�������̼���Ƶ��������ٸ�����������������㣻
��6��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
��2��̼������Һͨ�������̼��������̼�����ƣ�
��3��̼�����Ƽ������ֽ⣬����ֱ�Ӽ��ȳ�ȥ����̼�����ƣ�
��4�����ݳ���������Ҫ���������������ټ�����Լ�ֻ�������ʷ�Ӧ��������ԭ���ʷ�Ӧ���ڷ�Ӧ���������µ����ʣ�̼��������Һ�е�̼���ƿ���ͨ�������̼ʹ��ת��Ϊ̼�����ƣ��ݴ˻ش�
��5�����ȷ�����Ӧ��2NaHCO3
| ||
| V |
| V m |
��6��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
���
�⣺��1������̼�����ƹ��弴�ɵ�̼���ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3
Na2CO3+CO2��+H2O���ʴ�Ϊ��2NaHCO3
Na2CO3+CO2��+H2O��
��2��̼������Һͨ�������̼��������̼�����ƣ���Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CO2+H2O=2NaHCO3���ʴ�Ϊ��Na2CO3+CO2+H2O=2NaHCO3��
��3����ȥ̼���ƹ����л��е�����̼�����ƣ�̼���ƽ��ȶ���̼�����Ƽ������ֽ⣬����ͨ�����ȷ�����ȥ����̼�����ƣ���Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3
Na2CO3+CO2��+H2O��
�𣺿���ͨ�����ȷ�����ȥ����̼�����Ƽ���Ӧ����ʽΪ2NaHCO3
Na2CO3+CO2��+H2O��
��4������ͨ�������̼ʹ��ת��Ϊ̼�����Ƴ�ȥ����Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CO2+H2O�T2NaHCO3�����Ҷ�����̼��̼������֮�䲻�ᷢ����Ӧ��
�𣺿���ͨ�������̼ʹ��ת��Ϊ̼�����Ƴ�ȥ����Ӧ����ʽΪNa2CO3+CO2+H2O�T2NaHCO3��
��5���õ�����5.6L����״����Ϊ������̼�������ʵ���=
=0.25mol��
2NaHCO3
Na2CO3+H2O+CO2��
2 1
n��NaHCO3�� 0.25mol
��n��NaHCO3��=
=0.5mol
��m��NaHCO3��=0.5mol��84g/mol=42g
��̼���Ƶ�����Ϊ��95g-42g=53g��
��̼���Ƶ���������=
��100%=55.8%��
�𣺻������̼����ȥ����������55.8%��
��6��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
�𣺲ⶨ����̼���Ƶ����������ķ���Ϊ��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
| ||
| ||
��2��̼������Һͨ�������̼��������̼�����ƣ���Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CO2+H2O=2NaHCO3���ʴ�Ϊ��Na2CO3+CO2+H2O=2NaHCO3��
��3����ȥ̼���ƹ����л��е�����̼�����ƣ�̼���ƽ��ȶ���̼�����Ƽ������ֽ⣬����ͨ�����ȷ�����ȥ����̼�����ƣ���Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3
| ||
�𣺿���ͨ�����ȷ�����ȥ����̼�����Ƽ���Ӧ����ʽΪ2NaHCO3
| ||
��4������ͨ�������̼ʹ��ת��Ϊ̼�����Ƴ�ȥ����Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CO2+H2O�T2NaHCO3�����Ҷ�����̼��̼������֮�䲻�ᷢ����Ӧ��
�𣺿���ͨ�������̼ʹ��ת��Ϊ̼�����Ƴ�ȥ����Ӧ����ʽΪNa2CO3+CO2+H2O�T2NaHCO3��
��5���õ�����5.6L����״����Ϊ������̼�������ʵ���=
| 5.6L |
| 22.4L/mol |
2NaHCO3
| ||
2 1
n��NaHCO3�� 0.25mol
��n��NaHCO3��=
| 0.25mol��2 |
| 1 |
��m��NaHCO3��=0.5mol��84g/mol=42g
��̼���Ƶ�����Ϊ��95g-42g=53g��
��̼���Ƶ���������=
| 53 |
| 95 |
�𣺻������̼����ȥ����������55.8%��
��6��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
�𣺲ⶨ����̼���Ƶ����������ķ���Ϊ��һ��ͨ�����ȷֽ��ռ����ɵ��������̼�����Ƶ������ٷ���������̼���Ƶ������������������Լ����Ȼ���ʹ̼���������ͨ�������������������̼���Ƶ��������Ӷ�����̼���Ƶ�����������
���������⿼��̼���Ƽ���̼�����Ƶ�ת�������ӣ����㣬����ƴ������Ŀ���Ѷ��еȣ�ע����ݷ���ʽ���㣮

��ϰ��ϵ�д�
 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
�����Ŀ
��֪�����ӵ�����NAԼΪ6.02��1023mol-1���ֲⶨ��һ������ˮ�к���2NA��ˮ���ӣ����ˮ�����ʵ���Ϊ��������
| A��0.2mol |
| B��0.5mol |
| C��1mol |
| D��2mol |
 ������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź���������ͼ������A������˵���У���ȷ���ǣ�˫ѡ����������
������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź���������ͼ������A������˵���У���ȷ���ǣ�˫ѡ����������| A��A����������������һ���������ܷ���ˮ�ⷴӦ |
| B��A��һ�������¿���4 mol H2�����ӳɷ�Ӧ |
| C����������A���ӽṹ�������л���ֻ��1�� |
| D����A����ͬ������ͬ���칹��ֻ��2�� |