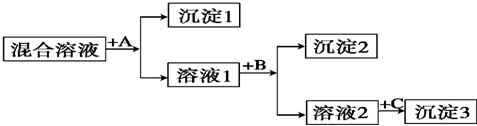
题目内容
Na2O2是常见的氧化剂.某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
实验步骤:
I.按下图所示装置组装仪器,并检查装置气密性.
Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热试管底部.
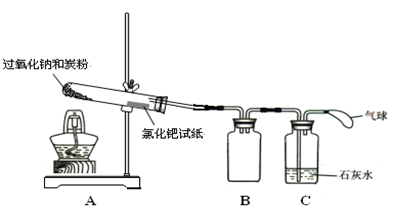
实验现象:
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)装置A中发生的反应为2Na2O2+C
Na2CO3+X,在该反应中,X是 (填氧化或还原)产物.
(2)如何检查装置气密性 .
(3)装置B的作用是
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种物质.已知反应过程中转移6.02×l023个电子时,生成53g Pd (已知Pd的相对原子质量为106),该反应的化学方程式为 .
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是 (填化学式).
②溶液中下列关系正确的是 (填字母序号).
a.c(Na+)>c(CO
)>c(OH-)>c(HCO
)
b.c(Na+)>c(OH-)>c(CO
)>c(HCO
)
c.c(Na+)═2c(CO
)+c(HCO
)+c(H2CO3)
d.c(H+)+c(Na+)═c(OH-)+2c(CO
)+c(HCO
)
③若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7(不考虑CO2的溶解),该盐酸的物质的量浓度为 .
实验步骤:
I.按下图所示装置组装仪器,并检查装置气密性.
Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热试管底部.

实验现象:
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)装置A中发生的反应为2Na2O2+C
| ||
(2)如何检查装置气密性
(3)装置B的作用是
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种物质.已知反应过程中转移6.02×l023个电子时,生成53g Pd (已知Pd的相对原子质量为106),该反应的化学方程式为
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是
②溶液中下列关系正确的是
a.c(Na+)>c(CO
2- 3 |
- 3 |
b.c(Na+)>c(OH-)>c(CO
2- 3 |
- 3 |
c.c(Na+)═2c(CO
2- 3 |
- 3 |
d.c(H+)+c(Na+)═c(OH-)+2c(CO
2- 3 |
- 3 |
③若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7(不考虑CO2的溶解),该盐酸的物质的量浓度为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)依据原子个数守恒判断X,再根据化合价判断;
(2)使装置内外形成压强差可用来检验装置气密性;
(3)B为安全瓶;
(4)n(Pd)=
=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl;
(5)①反应生成Na2CO3和Na2O,Na2O和水反应生成NaOH;
②反应后溶液呈碱性,结合电荷守恒判断;
③反应溶液溶质为NaCl,根据质量守恒计算.
(2)使装置内外形成压强差可用来检验装置气密性;
(3)B为安全瓶;
(4)n(Pd)=
| 53g |
| 106g/mol |
(5)①反应生成Na2CO3和Na2O,Na2O和水反应生成NaOH;
②反应后溶液呈碱性,结合电荷守恒判断;
③反应溶液溶质为NaCl,根据质量守恒计算.
解答:
解:(1)2Na2O2+C
Na2CO3+X,由原子个数守恒,可知X中含有2个钠原子1个氧原子,所以X为Na2O,是化合价减低的产物,即还原产物;
故答案为:还原;
(2)检验装置气密性方法:在广口瓶C中加水浸没导管口,用酒精度微热A处试管,若C中导管口冒气泡,移开酒精度冷却后形成水柱,说明气密性良好;
故答案为:在广口瓶C中加水浸没导管口,用酒精度微热A处试管,若C中导管口冒气泡,移开酒精度冷却后形成水柱,说明气密性良好;
(3)B为安全瓶,可防止倒吸;
故答案为:防止倒吸;
(4)n(Pd)=
=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl,则反应的方程式为PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(5)①反应生成Na2CO3和Na2O,Na2O和水反应生成NaOH,故答案为:NaOH、Na2CO3;
②由于CO32-水解,则c(CO32-)<c(OH-),故a错误、b正确;根据电荷应溶液中还存在NaOH,则c错误,由电荷守恒可知d正确,故答案为:b d;
③n(Na2O2)=
=0.05mol,反应后溶液溶质为NaCl,则生成NaCl0.1mol,
所以c(HCl)=c(NaCl)=
=1mol/L,
故答案为:1 mol/L.
| ||
故答案为:还原;
(2)检验装置气密性方法:在广口瓶C中加水浸没导管口,用酒精度微热A处试管,若C中导管口冒气泡,移开酒精度冷却后形成水柱,说明气密性良好;
故答案为:在广口瓶C中加水浸没导管口,用酒精度微热A处试管,若C中导管口冒气泡,移开酒精度冷却后形成水柱,说明气密性良好;
(3)B为安全瓶,可防止倒吸;
故答案为:防止倒吸;
(4)n(Pd)=
| 53g |
| 106g/mol |
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(5)①反应生成Na2CO3和Na2O,Na2O和水反应生成NaOH,故答案为:NaOH、Na2CO3;
②由于CO32-水解,则c(CO32-)<c(OH-),故a错误、b正确;根据电荷应溶液中还存在NaOH,则c错误,由电荷守恒可知d正确,故答案为:b d;
③n(Na2O2)=
| 3.9g |
| 78g/mol |
所以c(HCl)=c(NaCl)=
| 0.1mol |
| 0.1L |
故答案为:1 mol/L.
点评:本题考查实验探究问题,涉及过氧化钠的性质、离子浓度比较等问题,难度较大,注意根据反应的现象判断反应原理,把握实验基本操作方法,为高考常见题型.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
1molH2O中含有( )
| A、2个H原子 |
| B、1个O原子 |
| C、1个H2O分子 |
| D、2mol H 原子 |
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
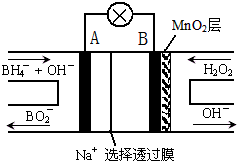

| A、电极B为正极 |
| B、放电过程中,Na+从正极区向负极区迁移 |
| C、电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA |
X、Y、Z、M、W为五种短周期元素,其中X、Y、Z是原子序数依次增大的同周期元素,且它们的最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准情况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A、Y、Z、W能形成含有相同电子数的简单离子,且W形成的简单离子的半径最大 |
| B、XZ2、W2Z2均为直线形的共价化合物 |
| C、Z与M形成的3原子化合物比Y的M形成的4原子化合物稳定 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.