题目内容
14.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
分析 A.铁与氯气反应生成氯化铁;
B.标准状况下水的状态不是气体;
C.1mol氨气分子中含有4mol原子;
D.根据n=cV计算出硫酸钠的物质的量,从而可知硫酸根离子的数目.
解答 解:A.1mol铁与足量氯气反应生成1mol氯化铁,铁失去了3mol电子,Fe失去电子数为3NA,故A正确;
B.标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算22.4L水的物质的量,故B错误;
C.1molNH3所含原子的物质的量为4mol,含有的原子数为4NA,故C错误;
D.0.5L 0.2 mol•L-1硫酸钠溶液中含有溶质硫酸钠0.1mol,0.1mol硫酸钠能够电离出0.1mol硫酸根离子,则溶液中含有的SO42-离子数目为0.1NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验现象中有白烟出现的是( )
| A. | 铜丝在Cl2中燃烧 | B. | 铁丝在氧气中燃烧 | ||
| C. | 氢气在氯气中燃烧 | D. | Na在Cl2中燃烧 |
5.下列关于乙酸的说法正确的是( )
| A. | 常温下是一种无色无味的气体 | B. | 能和乙醇发生加成反应 | ||
| C. | 能和Na2CO3溶液反应 | D. | 能使紫色石蕊试液变蓝 |
2.光导纤维是一种性能优越的通讯材料,它含有的主要物质是( )
| A. | Al | B. | Cu | C. | Si | D. | SiO2 |
9.下列有关说法不正确的是( )
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 常温下可用铁、铝制容器来盛装浓硝酸或浓硫酸 |
19.根据下列实验事实得出的相应结论正确的是( )
| 序号 | 实验事实 | 结论 |
| A | SO3的水溶液可以导电 | SO3是电解质 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>HClO |
| D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法中正确的是( )
| A. | 链状有机物C5H7Cl,其结构中肯定含一个碳碳双键 | |
| B. | C8H10是苯的同系物,它共有3中不同的结构 | |
| C. | 聚氯乙烯(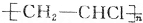 )的相对分子质量一定比聚乙烯( )的相对分子质量一定比聚乙烯( )的大34.5n )的大34.5n | |
| D. | 可用银氨溶液区别葡萄糖和果糖 |
