题目内容
6.如图1,用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体.它们之间在一定条件下反应流程如图2所示.其中F、D中原子核外电子总数相等,E是常见的导致温室效应的气体.常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G.上述反应流程没有其他物质参与.(1)写出上述反应流程中生成A的离子方程式CO2+NH3+H2O=NH4++HCO3-.
(2)写出在催化剂的作用下D与C反应的化学方程式4NH3+3O2$\frac{\underline{催化剂}}{△}$2N2+6H2O.
(3)写出电解A溶液反应的总离子方程式2NH4++2HCO3-$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑+2NH3↑+2CO2↑.

分析 用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体,E是常见的导致温室效应的气体,则E是CO2,电解A能生成二氧化碳,说明电解过程中有氢离子生成,A为碳酸盐或碳酸氢盐,B和C能燃烧生成F,两种气体为氢气、氧气,阴极附近生成的氢氧根离子和铵根离子能反应生成氨气,F、D中原子核外电子总数相等,则D是NH3,常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G,则G是(NH4)2CO3,所以A是NH4HCO3,D能在C中燃烧则,C是O2、B是H2,据此分析解答.
解答 解:用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体,E是常见的导致温室效应的气体,则E是CO2,电解A能生成二氧化碳,说明电解过程中有氢离子生成,A为碳酸盐或碳酸氢盐,B和C能燃烧生成F,两种气体为氢气、氧气,阴极附近生成的氢氧根离子和铵根离子能反应生成氨气,F、D中原子核外电子总数相等,则D是NH3,常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G,则G是(NH4)2CO3,所以A是NH4HCO3,D能在C中燃烧则,C是O2、B是H2,
(1)二氧化碳、氨气和水以1:1:1反应生成碳酸氢铵,则生成A的离子反应方程式CO2+NH3+H2O=NH4++HCO3-,故答案为:CO2+NH3+H2O=NH4++HCO3-;
(2)在催化剂条件下,D和C反应生成氮气和水,化学反应方程式4NH3+3O2$\frac{\underline{催化剂}}{△}$2N2+6H2O,
故答案为:4NH3+3O2$\frac{\underline{催化剂}}{△}$2N2+6H2O;
(3)电解A溶液生成氨气、氢气、氧气和二氧化碳,离子方程式为2NH4++2HCO3-$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑+2NH3↑+2CO2↑,故答案为:2NH4++2HCO3-$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑+2NH3↑+2CO2↑.
点评 本题考查无机物推断及电解原理,为高频考点,正确推断各物质成分是解本题关键,熟悉常见元素化合物性质、离子之间发生的反应等知识点,该题电解时生成四种气体,很多同学往往漏掉溶液中电极附近存在的氢离子、氢氧根离子能分别和弱酸根离子、铵根离子反应而导致错误,题目难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 淀粉、纤维素、油脂都属于高分子化合物 | |
| B. | 天然蛋白蛋水解的最终产物均是氨基酸 | |
| C. | 羧酸能发生酯化反应 | |
| D. | 油脂水解得到的醇是丙三醇 |
| A. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| B. | 向水中加入酸或碱,都可抑制水的电离,使水的离子积减小 | |
| C. | 加水稀释,碳酸钠溶液的c(H+)减小 | |
| D. | 温度由25℃升高到50℃,0.1 mol/L硫酸溶液的c(H+)基本不变 |
| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
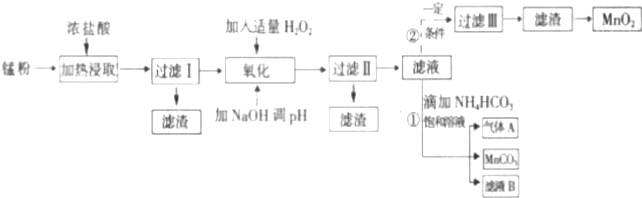
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过滤①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/LH2C2O4 50.00ml,MnO2完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O.然后用0.1mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液 30.00mL,求锰粉中的锰元素质量分数是24.06%(保留2位有效数字).
| A. | 溶于水后加石灰水,看有无沉淀 | |
| B. | 加稀盐酸观察是否有气体产生 | |
| C. | 溶于水后加CaCl2溶液,看有无沉淀 | |
| D. | 在无色火焰上灼烧,观察火焰是否呈黄色 |
| A. | 1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA | |
| B. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA | |
| C. | 常温常压下,20g D2O含有的原子总数为3NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合气体中分子总数小于2NA |