题目内容
4.下列说法中正确的是( )| A. | 链状有机物C5H7Cl,其结构中肯定含一个碳碳双键 | |
| B. | C8H10是苯的同系物,它共有3中不同的结构 | |
| C. | 聚氯乙烯(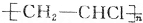 )的相对分子质量一定比聚乙烯( )的相对分子质量一定比聚乙烯( )的大34.5n )的大34.5n | |
| D. | 可用银氨溶液区别葡萄糖和果糖 |
分析 A、链状有机物C5H7Cl,把氯原子看成氢原子,其不饱和度=$\frac{2×5+2-8}{2}$=2;
B、分子式为C8H10的芳香烃,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3;若有2个侧链,为-CH3,有邻、间、对三种,据此解答;
C、聚氯乙烯(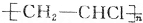 )和聚乙烯(
)和聚乙烯( )中的n不一定相同;
)中的n不一定相同;
D、葡萄糖中含有醛基,能发生银镜反应;果糖中不含有醛基,不能发生银镜反应;
解答 解:A、链状有机物C5H7Cl,把氯原子看成氢原子,其不饱和度=$\frac{2×5+2-8}{2}$=2,含2个碳碳双键或1个碳碳三键,故A错误;
B、分子式为C8H10的芳香烃,分子中含有1个苯环,其不饱和度=$\frac{2×8+2-10}{2}$=4,故侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种,故符合条件的结构共有4种,故B错误;
C、聚氯乙烯(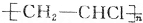 )和聚乙烯(
)和聚乙烯( )中的n不一定相同,所以
)中的n不一定相同,所以
前者相对分子质量一定比后者大34.5n,故C错误;
D、葡萄糖中含有醛基,能发生银镜反应;果糖中不含有醛基,不能发生银镜反应,所以可用银氨溶液区别葡萄糖和果糖,故D正确;
故选D.
点评 本题考查有机物的结构与性质、同分异构体的书写,难度不大,注意高聚物中n不一定相同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
12.下列说法中正确的是( )
| A. | 用铁与稀硝酸反应来制备氢气 | |
| B. | 氨气、液氨和氨水是同一种物质 | |
| C. | NO2溶于水发生了氧化还原反应,它既是氧化剂又是还原剂 | |
| D. | 钠在氧气中燃烧发出白光,生成白色固体氧化钠 |
9.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g)═CH3OH(g)
(1)判断该反应达到平衡状态的依据是bc(填标号).
a.消耗CO的速率与生成CH3OH的速率相等
b.气体的压强不再改变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度相等
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min 后,达到平衡时测得c(CO)=0.2mol•L-1,则以CH3OH表示该过程中平均反应速率v(CH3OH)=0.08mol•(L•mol)-1;CO的平衡转化率为80%.
(3)在250℃时,某时刻测得该温度下该密闭容器中各物质的物质的量浓度见下表:
此时反应的正、逆反应速率的关系是:v(正)>(填“>”、“<”或“=”)v(逆).
(4)如图所示,甲为恒容密闭容器,乙为恒压密闭容器.在甲乙两容器中分别充入等物质的量的H2和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CO(g)+2H2(g)═CH3OH(g),并维持反应过程中温度不变.已知甲容器中CO的转化率随时间变化的曲线如图所示,请在图2中画出乙容器CO的转化率随时间变化的曲线.

CO(g)+2H2(g)═CH3OH(g)
(1)判断该反应达到平衡状态的依据是bc(填标号).
a.消耗CO的速率与生成CH3OH的速率相等
b.气体的压强不再改变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度相等
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min 后,达到平衡时测得c(CO)=0.2mol•L-1,则以CH3OH表示该过程中平均反应速率v(CH3OH)=0.08mol•(L•mol)-1;CO的平衡转化率为80%.
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
(4)如图所示,甲为恒容密闭容器,乙为恒压密闭容器.在甲乙两容器中分别充入等物质的量的H2和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CO(g)+2H2(g)═CH3OH(g),并维持反应过程中温度不变.已知甲容器中CO的转化率随时间变化的曲线如图所示,请在图2中画出乙容器CO的转化率随时间变化的曲线.

16.若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA | |
| B. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA | |
| C. | 常温常压下,20g D2O含有的原子总数为3NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合气体中分子总数小于2NA |
8.下列说法正确的是( )
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,其反应类型相同 | |
| B. | 某烷烃R的相对分子质量为86,其氯代物只有2种,则R的名称一定为2,3-二甲基丁烷 | |
| C. | 若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物只有CHCl3 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
9.将5.6gFe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为( )
| A. | 1120mL | B. | 2240mL | C. | 3360mL | D. | 4480mL |
