题目内容
19.根据下列实验事实得出的相应结论正确的是( )| 序号 | 实验事实 | 结论 |
| A | SO3的水溶液可以导电 | SO3是电解质 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>HClO |
| D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO3是非电解质;
B.能和硝酸酸化的氯化钡溶液反应生成白色沉淀的离子还有SO32-、Ag;
C.发生强酸制取弱酸的反应;
D.通过焰色反应检验钾离子时,观察火焰颜色时需要通过蓝色的钴玻璃观察.
解答 解:A.溶液导电,原因是SO3和水反应生成硫酸,SO3不能电离出离子,为非电解质,故A错误;
B.能和硝酸酸化的氯化钡溶液反应生成白色沉淀的离子有SO42-、SO32-、Ag+,故B错误;
C.将CO2通入Ca(ClO)2到溶液中产生白色沉淀碳酸钙,在溶液中发生强酸制取弱酸的反应,则酸性为H2CO3>HClO,故C正确;
D.实验室检验K+的存在用焰色反应,可以观察到紫色火焰,但要通过蓝色钴玻璃观察,以便滤去黄色光,避免干扰,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的检验和性质的比较,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
10.下列实验操作都能够达到预期目的是( )
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸,并测得某溶液pH为3.1 | |
| B. | 中和pH与体积均相同的NaOH溶液和氨水,结果消耗H2SO4的物质的量一样多 | |
| C. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 | |
| D. | 在HCl气氛中蒸干AlCl3溶液能到得纯净的无水氯化铝 |
7.下列化合物中,不能由单质之间直接化合生成的是( )
| A. | Fe3O4 | B. | Na2O2 | C. | CuCl2 | D. | FeCl2 |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
11.面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如下图所示:
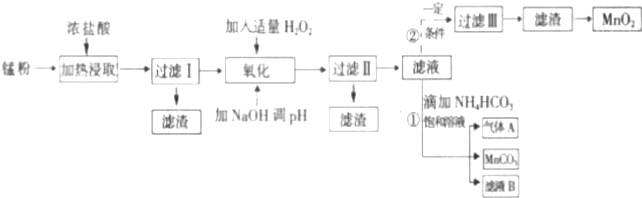
根据以上信息回答问题:
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过滤①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/LH2C2O4 50.00ml,MnO2完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O.然后用0.1mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液 30.00mL,求锰粉中的锰元素质量分数是24.06%(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过滤①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/LH2C2O4 50.00ml,MnO2完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O.然后用0.1mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液 30.00mL,求锰粉中的锰元素质量分数是24.06%(保留2位有效数字).
8.将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为5:2,则原混合物中氧化铁与铁的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:5 |
9.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g)═CH3OH(g)
(1)判断该反应达到平衡状态的依据是bc(填标号).
a.消耗CO的速率与生成CH3OH的速率相等
b.气体的压强不再改变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度相等
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min 后,达到平衡时测得c(CO)=0.2mol•L-1,则以CH3OH表示该过程中平均反应速率v(CH3OH)=0.08mol•(L•mol)-1;CO的平衡转化率为80%.
(3)在250℃时,某时刻测得该温度下该密闭容器中各物质的物质的量浓度见下表:
此时反应的正、逆反应速率的关系是:v(正)>(填“>”、“<”或“=”)v(逆).
(4)如图所示,甲为恒容密闭容器,乙为恒压密闭容器.在甲乙两容器中分别充入等物质的量的H2和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CO(g)+2H2(g)═CH3OH(g),并维持反应过程中温度不变.已知甲容器中CO的转化率随时间变化的曲线如图所示,请在图2中画出乙容器CO的转化率随时间变化的曲线.

CO(g)+2H2(g)═CH3OH(g)
(1)判断该反应达到平衡状态的依据是bc(填标号).
a.消耗CO的速率与生成CH3OH的速率相等
b.气体的压强不再改变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度相等
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<(填“>”、“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min 后,达到平衡时测得c(CO)=0.2mol•L-1,则以CH3OH表示该过程中平均反应速率v(CH3OH)=0.08mol•(L•mol)-1;CO的平衡转化率为80%.
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
(4)如图所示,甲为恒容密闭容器,乙为恒压密闭容器.在甲乙两容器中分别充入等物质的量的H2和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CO(g)+2H2(g)═CH3OH(g),并维持反应过程中温度不变.已知甲容器中CO的转化率随时间变化的曲线如图所示,请在图2中画出乙容器CO的转化率随时间变化的曲线.
