题目内容
2.光导纤维是一种性能优越的通讯材料,它含有的主要物质是( )| A. | Al | B. | Cu | C. | Si | D. | SiO2 |
分析 在信息产业高速发达的今天,二氧化硅是作为光纤制品的基本原料,功不可没.
解答 解:制造光导纤维的主要原料是二氧化硅,故选D.
点评 本题考查了二氧化硅在生产、生活中的用途,属于识记性题目,得分较易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列说法错误的是( )
| A. | 强碱溶液会腐蚀光导纤维 | |
| B. | 硅是良好的半导体,是信息技术的关键材料 | |
| C. | 碳化硅具有金刚石结构,硬度大,可以作砂轮的磨料 | |
| D. | 水晶镜片所用原料为晶体硅 |
13.某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100mL的两份溶液进行如下实验.
①第一份加过量NaOH溶液后加热,收集到0.03mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
①第一份加过量NaOH溶液后加热,收集到0.03mol气体,无沉淀生成,同时得到溶液甲.
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体.
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生.下列有关叙述正确的是( )
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L | |
| B. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| C. | n(NH4+):n(Al3+):n(SO42-)=3:1:10 | |
| D. | 原溶液一定存在Cl- |
10.下列实验操作都能够达到预期目的是( )
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸,并测得某溶液pH为3.1 | |
| B. | 中和pH与体积均相同的NaOH溶液和氨水,结果消耗H2SO4的物质的量一样多 | |
| C. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 | |
| D. | 在HCl气氛中蒸干AlCl3溶液能到得纯净的无水氯化铝 |
17.下列叙述正确的是( )
| A. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| B. | 向水中加入酸或碱,都可抑制水的电离,使水的离子积减小 | |
| C. | 加水稀释,碳酸钠溶液的c(H+)减小 | |
| D. | 温度由25℃升高到50℃,0.1 mol/L硫酸溶液的c(H+)基本不变 |
7.下列化合物中,不能由单质之间直接化合生成的是( )
| A. | Fe3O4 | B. | Na2O2 | C. | CuCl2 | D. | FeCl2 |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 铁与足量氯气反应,1mol Fe失去电子数为3NA | |
| B. | 标准状况下,22.4LH2O所含的分子数为NA | |
| C. | 1molNH3所含原子数为NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
11.面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如下图所示:
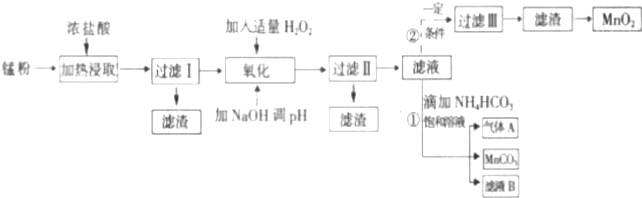
根据以上信息回答问题:
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过滤①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/LH2C2O4 50.00ml,MnO2完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O.然后用0.1mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液 30.00mL,求锰粉中的锰元素质量分数是24.06%(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过滤①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/LH2C2O4 50.00ml,MnO2完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O.然后用0.1mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液 30.00mL,求锰粉中的锰元素质量分数是24.06%(保留2位有效数字).
12.下列说法中正确的是( )
| A. | 用铁与稀硝酸反应来制备氢气 | |
| B. | 氨气、液氨和氨水是同一种物质 | |
| C. | NO2溶于水发生了氧化还原反应,它既是氧化剂又是还原剂 | |
| D. | 钠在氧气中燃烧发出白光,生成白色固体氧化钠 |