题目内容
1.52g铜镁合金完全溶解于50mL 63%的浓硝酸(硝酸密度为1.40g/mL)中,得到标况下NO2和N2O4 的混合气体1120mL.向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是 ( )
| A、该合金中nCu:nMg=2:1 |
| B、合金完全溶解时,溶液中C(H+)=8mol/L(忽略反应前后溶液体积变化) |
| C、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D、得到2.54g沉淀时,加入NaOH溶液的体积是600mL. |
考点:有关混合物反应的计算
专题:计算题
分析:金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根离子的质量为:2.54g-1.52g=1.02g,氢氧根离子的物质的量为:
=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得:x=0.02、y=0.01;
标况下1.12L气体的物质的量为:
=0.05mol,设混合气体中二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知:a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol、四氧化二氮0.01mol;
63%的浓硝酸(硝酸密度为1.40g/mL)的浓度为:
mol/L=14mol/L,50mL该硝酸中含有硝酸的物质的量为:14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据N元素守恒,硝酸钠的物质的量为:0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为:
=0.64L=640mL;
根据以上分析进行解答.
| 1.02g |
| 17g/mol |
标况下1.12L气体的物质的量为:
| 1.12L |
| 22.4L/mol |
63%的浓硝酸(硝酸密度为1.40g/mL)的浓度为:
| 1000×1.40×63% |
| 63 |
| 0.64mol |
| 1mol/L |
根据以上分析进行解答.
解答:
解:A.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根离子的质量为:2.54g-1.52g=1.02g,氢氧根离子的物质的量为:
=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得:x=0.02、y=0.01,则该合金中n(Cu):n(Mg)=2:1,故A正确;
B.根据D可知,硝酸溶液中硝酸总物质的量为0.7mol,金属与硝酸反应生成硝酸铜、硝酸镁,含有的硝酸根离子的物质的量为:(0.01+0.02)mol×2=0.06mol,根据N原子守恒可知,反应后剩余的硝酸为:0.7mol-0.04mol+0.01mol×2-0.06mol=0.58mol,所以合金完全溶解时,溶液中c(H+)=
=11.6mol/L,故B错误;
C.标况下1.12L气体的物质的量为:
=0.05mol,设混合气体中二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知:a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol、四氧化二氮0.01mol,NO2和N2O4的混合气体中,NO2的体积分数为:
×100%=80%,故C正确;
D.63%的浓硝酸(硝酸密度为1.40g/mL)的浓度为:
mol/L=14mol/L,50mL该硝酸中含有硝酸的物质的量为:14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据N元素守恒,硝酸钠的物质的量为:0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为:
=0.64L=640mL,故D错误;
故选BD.
| 1.02g |
| 17g/mol |
B.根据D可知,硝酸溶液中硝酸总物质的量为0.7mol,金属与硝酸反应生成硝酸铜、硝酸镁,含有的硝酸根离子的物质的量为:(0.01+0.02)mol×2=0.06mol,根据N原子守恒可知,反应后剩余的硝酸为:0.7mol-0.04mol+0.01mol×2-0.06mol=0.58mol,所以合金完全溶解时,溶液中c(H+)=
| 0.58mol |
| 0.05L |
C.标况下1.12L气体的物质的量为:
| 1.12L |
| 22.4L/mol |
| 0.04mol |
| 0.05mol |
D.63%的浓硝酸(硝酸密度为1.40g/mL)的浓度为:
| 1000×1.40×63% |
| 63 |
| 0.64mol |
| 1mol/L |
故选BD.
点评:本题考查了混合物反应的计算,题目难度较大,注意质量守恒、电子守恒在混合物反应的计算中的应用方法,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列有关有机化合物的叙述正确的是( )
| A、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| B、卤代烃C4H8Cl2有四种同分异构体 |
| C、甲烷是天然气的主要成分,能发生加成反应 |
| D、用驴皮熬制成的胶(阿胶)是一种天然橡胶,属于天然高分子化合物 |
下列说法不正确的是( )
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|



 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.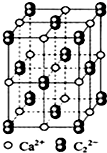 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2