题目内容
18.某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置.
(1)检查图1所示装置气密性的方法是用手捂住锥形瓶,观察乙中长导管内液面是否上升.
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量产生相同体积的气体所需时间.
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快.
(4)已知:①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1.
Al和FeO发生铝热反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
某同学认为,铝热反应可用于工业炼铁,你的判断是不能(填“能”或“不能”),
你的理由是成本太高,无经济利益.
分析 (1)检查装置气密性可以使用让装置温度升高压强增大的方法,观察气泡或液面变化;
(2)比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测定产生相同的氢气所需要的时间;
(3)金属与酸的反应为放热反应,温度影响化学反应速率;
(4)结合热化学方程式和盖斯定律计算得到所需热化学方程式,利用铝热反应大量制取金属时考虑经济效益,有没有更好的方法.
解答 解:(1)化学实验装置的气密性检验的原理是使装置内外的压强不相等,基本方法是观察气泡或液面变化,该装置利用不漏气装置内的空气受热膨胀,有空气从导管口逸出要检查装置的气密性,可以用手握住锥形瓶,使瓶内的温度升高,压强增大,若气密性良好,则会观察到乙中长导管内的液面会上升,
故答案为:用手捂住锥形瓶,观察乙中长导管内液面是否上升;
(2)比较产生气体的快慢,还可以测定产生相同的氢气所需要的时间,故答案为:产生相同体积的气体所需时间;
(3)金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快,故答案为:反应放热,溶液温度升高使反应速率加快;
(4)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1,
利用铝热反应在工业上大面积炼铁时,需要消耗冶炼成本更高的Al,冶炼Fe的成本就太高了,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1;不能;成本太高,无经济利益.
点评 本题考查了装置气密性的检查方法、测气体的反应速率的方法,熟悉影响速率的因素,依据已有的知识进行即可解答,题目较难度中等.

 高效智能课时作业系列答案
高效智能课时作业系列答案| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
| A. | BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应 | |
| B. | 弱碱性条件下,甲酸乙酯能与氢氧化铜反应,乙酸乙酯也能与氢氧化铜反应 | |
| C. | 苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色 | |
| D. | CO2与SiO2均为酸性氧化物,CO2能与NaOH溶液反应,SiO2也能与NaOH溶液反应 |
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
| A. | 从食盐溶液中获得食盐晶体采用蒸馏的方法 | |
| B. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| C. | 除去酒精中含有的较多量水采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
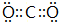 .
.