题目内容
7.对于反应中的能量变化,表述正确的是( )| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
分析 化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,形成化学键放出能量,反应物总能量大于生成物总能量,则为放热反应,反之为吸热反应,与反应条件无关,以此解答该题.
解答 解:A.从能量守恒的角度分析,反应物的总能量大于生成物的总能量,则为放热反应,故A正确;
B.断裂化学键吸收能量,故B错误;
C.可燃物燃烧都是放热反应,但需加热到可燃物的着火点,故C错误;
D.酸碱中和为放热反应,故D错误.
故选A.
点评 本题考查了化学反应的能量变化,为高频考点,侧重于学生的双基的考查,注意把握化学反应与能量变化的关系以及规律,理解相关概念,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.三个密闭容器中进行同样的可逆反应:aX(g)+Y(g)═2Z(g);△H<0,均维持T℃和容器体积不变,2min时,甲容器达到平衡.以下描述正确的是( )
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
2.下列各组物质中,所含分子数一定相同的是( )
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
19.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4环己二酮单乙二醇缩酮)为原料合成(如图).下列说法不正确的是( )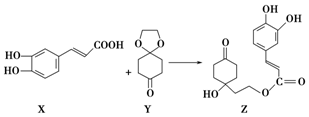

| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |

