题目内容
9. 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.(1)写出下列仪器的名称:
a.蒸馏烧瓶b.冷凝管c.容量瓶e.锥形瓶
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是酒精灯.冷凝水由g(填f或g)口通入.
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是未用玻璃棒引流.
②根据计算得知,用托盘天平所需称量NaOH的质量为2.0g.
③配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.称量计算出的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用
玻璃棒慢慢搅动,使其充分溶解并冷却至室温
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)物质的量浓度误差分析:(填偏高、偏低、无影响)
①用滤纸称量氢氧化钠偏低;
②定容时,若眼睛俯视刻度线,则所配制的溶液浓度将偏高;
③未冷却到室温就注入容量瓶定容偏高;
④配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液无影响.
分析 (1)由图可知仪器的名称;
(2)分离四氯化碳和酒精的混合物,需要蒸馏,选酒精灯加热,冷却水下进上出;
(3)①转移液体需要玻璃棒引流;
②结合m=cVM计算;
③配制溶液的步骤为计算、称量、溶解、冷却、转移、定容、摇匀、装瓶;
(4)结合c=$\frac{n}{V}$及不当操作对n、V的影响判断误差.
解答 解:(1)由图可知仪器的名称为a.蒸馏烧瓶,b.冷凝管,c.容量瓶,e.锥形瓶,故答案为:蒸馏烧瓶;冷凝管;容量瓶;锥形瓶;
(2)分离四氯化碳和酒精的混合物,需要蒸馏,还缺少的仪器是酒精灯.冷凝水由g口通入,故答案为:酒精灯; g;
(3)①图中的错误是未用玻璃棒引流,故答案为:未用玻璃棒引流;
②用托盘天平所需称量NaOH的质量为0.5L×0.1mol/L×40g/mol=2.0g,故答案为:2.0;
③配制溶液的步骤为计算、称量、溶解、冷却、转移、定容、摇匀、装瓶,则配制时,其正确的操作顺序是B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(4)①用滤纸称量氢氧化钠,NaOH潮解,称量NaOH的质量偏小,n偏小,由c=$\frac{n}{V}$可知,浓度偏低,故答案为:偏低;
②定容时,若眼睛俯视刻度线,V偏小,由c=$\frac{n}{V}$可知,则所配制的溶液浓度将偏高,故答案为:偏高;
③未冷却到室温就注入容量瓶定容,V偏小,由c=$\frac{n}{V}$可知,则所配制的溶液浓度将偏高,故答案为:偏高;
④配好的溶液转入干净的试剂瓶时,不慎溅出部分溶液,对浓度无影响,故答案为:无影响.
点评 本题考查混合物分离提纯实验及溶液配制实验,为高频考点,把握仪器的使用、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意配制溶液的步骤及误差分析,题目难度不大.

| A. | 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向稀盐酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
②Fe(s)+H2O(g)?FeO(s)+H2(g)?K2
③H2(g)+CO2(g)?H2O(g)+CO(g)?K3
又已知在不同的温度下,K1、K2数值如表:
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)反应②的平衡常数表达式为K=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$,此反应在恒温恒容的密闭装置中进行,能充分说明此反应已达到平衡的标志是AB.
A.气体的平均相对分子质量不再改变 B.气体的总质量不再改变
C.气体的总分子数不再改变 D.容器内压强不随时间变化而变化
(3)若900℃时进行反应 ③,其平衡常数K3为1.5(求具体数值),焓变△H>0(填“>”、“<”、“=”).若已知该反应仅在高温时自发进行,则△S>0(填“>”、“<”、“=”).
(4)若500℃时进行反应 ③,在某时刻时C(H2)=C(CO2)=C(H2O)=C(CO),则此时否(填“是”、“否”)达到平衡状态;若没有达到平衡状态,则此时该反应正在向逆(填“正”、“逆”)方向进行,理由为:浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动.
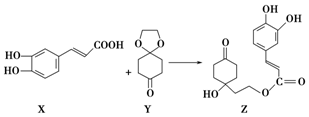
| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |
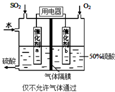 回答下列问题:
回答下列问题: